پرتودرمانی در طب زنان
Radiation Therapy in Gynecology
زندگی تمام موجودات در عرصه ای تکامل حاصل کرده است که در آن انرژی تابشی منبع اصلی انرژی ضروری برای بیشتر روند های زیستی است. نور خورشید گرما، نور، و انرژی لازم برای فوتوسنتز گیاهان را تولید می کند و امواج رادیویی وسیله ای برای برقراری ارتباط هستند. این پرتوها برای زندگی موجودات مفید بوده و در مقادیر عادی مضر نیستند. انواع خاصی از پرتوهای پرانرژی یا یونیزان در این حد هم بدون ضرر نیستند، ولی به هر حال ابزار لازم جهت تشخیص و یا درمان در طب زنان را فراهم می کنند. این پرتوهای پر انرژی ممکن است برای عناصر زیستی زیان آور باشند، از این روست که در سرطان شناسی به کار گرفته می شوند، چراکه پس از رسانیدن آسیب به بافت ها، بافت سالم در مقایسه با بافت بدخیم به شیوه موثرتری بهبود می یابد. پرتوهای فوق، آثار مخربی بر تمامی انواع حیات از گیاهان نسبتاً ساده تک سلولی گرفته تا ارگانیسم های پیچیده عالی دارند.
تغییر حاصل از پرتوهای یونیزان ممکن است اندکی پس از اینکه موجود زنده در معرض آن قرار گرفت کاملاً واضح و با چشم غیر مسلح قابل رویت باشند، اما در بسیاری از موارد در معاینه معمولی آثار پرتو بر ارگانیسم قابل ردیابی نیست. تغییرات حاصل از پرتو ممکن است آنقدر کوچک باشد که فقط با آزمایش های شیمیایی و میکروسکوپی قابل یافتن باشد. آثار ناشی از پرتو همچنین ممکن است تا سالها بروز نکند و یا ممکن است در نسل بعدی ارگانیسم پرتو دیده یافت شود.
پرتو حاصل از تست های تشخیصی، پرتوتابی درمانی ، و پرتوهایی که تصادفاً از محیط اطراف به شخص می رسند ممکن است همگی مضر باشند. اگر چه اغلب شانس آسیب مختصر است، احتمال آسیب در اثرمواجهه را در مقابل اطلاعات بدست آمده باید مد نظر داشت. با کنترل خطرات محیطی باید از موجهه تصادفی افراد کاسته شود.
ماهیت و آثار پرتوهای یونیزان
امواج الکترو مغناطیس طیف وسیعی از انرژی های فوتون را در بر می گیرد که از امواج رادیویی بلند تا امواج گاما(y) کوتاه متفاوت است.
پرتوهای آزاد شده از ایزوتوپ های رادیواکتیو (برای مثال، رادیوم، سزیوم و ایریدیوم) برای درمان بسیاری از بدخیمی ها بکار می رود. در طی چهل سال گذشته دستگاههایی ساخته شده اند که قادرند شدت های بالای انرژی تابشی (radiant) را تولید کنند (برای مثال [دستگاههای سوپرولتاژ و مگاولتاژ])، که این دستگاهها دردرمان بدخیمی ها کاربرد وسیع دارند. دستگاههایی که انرژی بیش از یک میلیون الکترون ولت (IMeV) تولید می کنند بیشتر مورد استفاده هستند و عبارتند از ژنراتورهای کبالت، بتاترون ها (betatrons) و شتاب دهنده های خطی (linear accelerators) (جدول 1).
ماهیت فیزیکی و شیمیایی
نیروهای فیزیکی مورد نظر به علت توانایی انتقال انرژی به ماده از طریق جدا کردن الکترون های اربیتالی از اتم ها و تکثیر جفت یون ها (ion pairs)، پرتوهای یونیزان (ionizing ) نامیده می شوند. واژه اخیراز آنجا که این پدیده ممکن است در اثر پرتوهای حاصل از ذرات یا امواج الکترومغناطیس ایجاد شود، واژه فراگیری است. موضوع مورد بحث ما به امواج الکترومغناطیسی در محدوده 7-10 تا10-10 سانتی متر (1 تا 0/001نانومتر) محدود می شود.
پرتوهایی که از یک هسته اتمی در حال تخریب به وجود می آیند پرتوهای (y) خوانده می شوند.و آنهایی که از خارج از هسته اتم نشات می گیرند و در اثر بمباران یک هدف مناسب همچون تنگستن (tungsten)توسط ذرات دارای انرژی بالا (الکترون ها )به وجود می آیند پرتوهای xخوانده می شوند. با رسیدن این الکترون ها که با سرعت بالایی حرکت می کنند به اطراف هسته اتم های ماده هدف، الکترون های مذکور از مسیر خود منحرف شده، در نتیجه انرژی به صورت پرتوی الکترومعناطیسی آزاد می شود. پرتوهای x آزاده شده ممکن است دارای انرژی صفر تا حداکثر انرژی ممکن که به وسیله انرژی کینتیک (kinetic) الکترون های impinging تعیین می شود، باشند. دستگاههایی چون بتاترون (betatron) قادرند الکترونهای با سرعت های بالا تولید کنند، در نتیجه پرتوهای x تولید شده دارای انرژی بالایی هستند. در صورتی که تعداد زیادی الکترونی impinging در این روند شرکت داشته باشند، طیف وسیعی از انرژی پرتوهای x تولید خواهد شد.
برخی پرتوهای x هنگامی تولید می شوند که الکترون های impinging با سرعت بالا یک الکترون را از اربیتال اتم هدف بیرون می اندازند (یونیزاسیون). جای این الکترون که ممکن است از یک لایه خارجی تر پر یم شود وطی این انتقال است که پرتوx تولید می شود. انرژی فوتونی اشعه x بیانگر اختلاف سطح الکترون لایه داخلی و خارجی است.
پرتوهای گاما وایکس را می توان مجموعاً فرتون نامید. آنچه از نظر زیست شناسی اهمیت دارد، انرژی فرتون هاست نه منبع وجود آورنده آنها. تعامل فرتون ها با ماده از طریق سه مکانیسم اتفاق می افتد: اثر فوتوالکتریک، افتراق compton و تولید جفتی (pair production). تمام پروسه های فوق به یونیزاسیون مولکولهای داخل ماده هدف و یا تشکیل رادیکالهای آزاد می انجامد. از بمباران آب با فوتون های پرانرژی اتم های آزاد هیدروژن و رادیکالهای آزاد هیدروکسیل به وجود می آید(شکل 2).
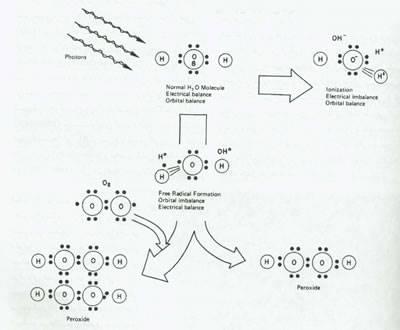
شکل 2:اثر پرتو تابی بر آب ،پرتوهای یونیزان یونهای آب تولید می کنند و ممکن ایت باعث بوجود آمدن رادیکال های آزاد از جمله پر اکسید شوند .در حضور اکسیژن خالص پروسه ی اخیر تسریع می شود.
نزدیک به نصف اتم های هیدروژن (H) با رادیکال های هیدروکسیل (OH) مواجه شده و تولید پراکسید (H2O2) می کنند. در پرتوتابی آب توسط الکترون ها یا فوتون ها تعداد بسیار کمی از اتم های H رادیکالهای OH آنقدر به هم نزدیک هستند که قبل از جدا شدن ازهم دوباره با هم واکنش می کنند. در حضور اکسیژن (O2) اتم های (H) با آن واکنش داده رادیکال (HO2) ایجاد می کنند. مولکول اخیر کمتر از رادیکال OH واکنش نشان می دهد و آب حاصل به H2O2 تبدیل می شود. این مولکولهای برانگیخته (excited) و یونیزه ثابت نیستند و با پروتئین ها و دیگر مواد کلیدی داخل سلولی واکنش می دهند. بسیاری از رویدادهای دیگر نیز ممکن است در اثر بمباران فوتونی اتفاق بیافتند: ممکن است مولکولهای با زنجیره بلند از هم جداشده، دوباره به هم متصل شوند، تجمع (aggregate) تشکیل شود، و ممکن است یک ساختار حلقه ای شکل بدون نظم خاصی از هم پاشیده شود. برخی پیوندهای شیمیایی ممکن است در مقابل اکسیداسیون مستعد غیر فعال شدن باشند و در نتیجه ظرفیت علمی (Funcitonal capactiy) کاهش خواهد یافت. تمام تغییرات شیمیایی ذکر شده ممکن است در نهایت به آسیب زیستی سلول بیانجامد.
جدول 1:مود الیته های رادیاسیون خارجی
|
مولالیته
|
ولتاژ
|
منبع
|
|
ولتاژ پایین (سطحی)
|
KV 150-85
|
اشعه ایکس
|
|
ولتاژ متوسط (ارتوولتاژ)
|
KV 400-180
|
اشعه ایکس
|
|
سوپر ولتاژ
|
8MV - 500KV
|
اشعه ایکس
60Co
Cs137
Ra 226
|
|
مگا ولتاژ
|
بیشتر از انرژی
سوپر ولتاژ
|
بتاترون
سینکروترون
شتاب دهنده خطی
|
آثار زیستی
مکانیزم آسیب سلولی در اثر پرتوتابی گوناکون است و ممکن است در زمانهای متفاوتی از رویداد اول [مواجهه با پرتو] و بسته به نوع هدف داخل سلولی و زمان لازم برای تاثیر مواد شیمیایی حاصل به وجود آید.
پس از آسیب به وسیله یونیزاسیون، سلول بالغی که در سطح فعالیت متابولیکی پائینی قرار دارد ممکن است از نظر ظاهری تحت تاثیر قرار نگرفته باشد، اما سلول فعال و در حال رشد ممکن است کاملاً تخریب شود. سلولهایی که در حال رشد ممکن است کاملاً تخریب شود. سلولهایی که در حال تقسیم هستند نسبت به سلول هایی که در فاز استراحت در فواصل میتوزها قرار دارند، بیشتر مستعد آسیب هستند.
فشار (tension) پایین اکسیژن، دهیدراسیون، انجماد (freezing) و حضور مواد احیا کننده ممکن است سلولها را از آسیب ناشی از پرتو محافظت کنند.
آسیب در اثر پرتوتابی به صورت تورم سلول، واکوئولیزه شدن سیتوپلاسم (vacuolization)، تشکیل سلول غول آسا (giant) و تکه تکه شدن یا جدا شدن تقریبی (partial) کروموزم ها درهنگام تقسیم بروز می کند (شکل 3). پس از یک فاز تاخیری (latent) شواهدی از مرگ سلولی به همراه از دست دادن ساختارهای سیتوپلاسمی و هسته ای دیده می شود. پاسخ سلول عبارت خواهد بود از یک واکنش التهابی تیپیک :ادم، اتساع و پرولیفراسیون مویرگ ها، ارتشاح (infilration) سلولهای گرد (round)، و رشد فیبروبلاست ها. این واکنش سریع با فیبروز تدریجی، از دست دادن عروق (avascularity) و محصور شدن منطقه آسیب دیده (wall off) دنبال می شود. تغییرات بسیار دیر رس عبارتند از :contracture و scarification به همراه شدن (inelastic) و اتساع عروق که توسط استرومای بدون عروق pinch off شده اند.
تخریب انتخابی بافت ها پایه و اساس رادیولوژی درمانی است. سلولهای نئوپلاستیک همیشه راحت تر از سلولهای والد (parent cells) بافت های طبیعی اطراف کشته می شوند. شدت (magnitude) اختلاف در استعداد [آسیب] به پرتوتابی بین بافت طبیعی و سرطانی در تعیین اینکه آیا قسمتی که برای پرتودرمانی در نظر گرفته شده است را می توان با پرتودرمانی در نظر گرفته شده است را می توان با پرتودرمانی ریشه کن کرد (eradicate) نقش بزرگی دارد. این تفاوت نسبی در استعداد بافت ها برای [آسیب توسط پرتو (radivulnerability) را اصطلاحاً حساسیت به پرتو (radiosensitiy) می نامند. حساسیت به پرتو و قابلیت درمان توسط پرتو (radioresistant) که در معرض دوز بالای پرتو موضعی قرار می گیرند قابل درمان هستند ولی تومورهای حساس به پرتو که در شروع درمان ویا مدت کوتاهی پس از شروع درمان متاستاز وسیع داده اند را فقط می توان به صورت موضعی کنترل کرد. یک مثال خوب از تومورهای مقاوم به پرتو که نسبتاً قابل درمان است کارسینوم سلول سنگفرشی گردن رحم است. این بدخیمی یکی از قابل درمان ترین تومورهاست زیرا سلولهای بافت طبیعی گردن رحم و واژن در اطراف آن به پرتوبسیار مقاوم هستند و می توان دوز بالایی از پرتو را برای درمان آن بکار برد. مورد اخیر یعنی بکارگیری دوز بالای پرتو رادیوم که بوسیله بافت های اطراف تحمل می شود، مساوی با موفقیت در درمان است.
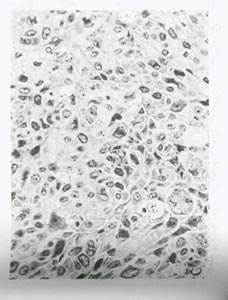
شکل 3:کارسینوم اپیدرموئید گردن رحم بلافاصله پس از قطع پرتو تابی .بیشترین تغییرات مورفولوژیک در سلول هایی دیده می شود که در حال میتوز هستند.به تورم و اختلال حاصل در دوک های میتوز توجه کنید (پیکان).سیتوپلاسم و هسته های سلول های مرحله اینترفاز و اکوئله (vacuolated)شده اند؛در مقایسه با الگوی سلولهای تومور قبل از پرتو تابی،سیتوپلاسم سلولها متورم است.
در نتیجه تغییرات شیمیایی در پاسخ به پرتوتابی، مولکولهای بسیار بزرگ سیستم زیستی متحمل تغییرات ساختاری گوناگونی می شود که ممکن است فونکسیون (عملکرد) آنها را تغییر دهد. در اثر پرتو، مولکولهای بزرگ به قطعه های کوچکتر شکسته می شوند. اتصال متقاطع (cross-linking) یکی دیگر از تغییرات ساختاری است. در مولکولهای بزرگ که تا حدی هم انعطاف پذیر هستند در صورتی که در اثر پرتو، لوکوس (locus) فعالی از نظر شیمیایی روی آنها بوجود آید و این نقطه با نقطه ی فعال دیگری تماس حاصل کند اتصال متقاطع اتفاق می افتد. در صورتی که اتصال متقاطع گسترده باشد، مولکول مذکور قادر نخواهد بود عملکرد طبیعی خود را انجام دهد و ممکن است دیگر در سیستم کارایی نداشته باشد. بسیاری از مولکولهای درشت (macromolecules) پس از cross-linking داخل مولکولی (پیوند گروههای مختلف شیمیایی) به شکل سخت (rigid) که عامل اتصال اغلب اتم های هیدروژن هستند در آمده و در نتیجه یک ساختاری سه بعدی تشکیل می شود. پیوندهای هیدروژنی از ضعیف ترین پیوندهای موجود در مولکول بوده و اولین پیوند هایی هستند درآمده که می شکنند. چنین تغییرات ساختاری ممکن است به تغییرات اساسی در خصوصیات بیوشیمیایی مولکول منجر شوند.
پرتوتابی بر مولکولهای همچون پروتئین ها، آنزیم ها، اسیدهای نوکلئیک و برخی لیپیدها آثار عمیقی داشته، می تواند ارگانیسم یا عضو مربوطه را دستخوش تغییر سازد. تغییر شیمیایی اولیه در کسری از ثانیه روی می دهد و به ندرت مستقیماً قابل ردیابی است. برخی از این تغییرات شیمیایی تقریباً بلافاصله ترمیم می شوند؛ دیگر تغییرات که در ساختارهای به نسبت کم اهمیت تر اتفاق می افتند ممکن است سبب تغییراتی شوند که به ندرت قابل تشخیص هستند. در بیشتر موارد، فاصله بین تغییر شیمیایی و ظاهر شدن اثر زیستی حاصل از آن پیچیده و مبهم است. جذب و استفاده از انرژی به وسیله سلول یک زنجیره پیچیده رویدادهایی را تشکیل می دهد که بسیاری از پروتئین ها در آن دخالت دارند. آسیب حاصل از پرتوتابی به این پروتئین های حیاتی ممکن است به از بین رفتن پیوستگی دیواره ای سلولی و مرگ سلول بیانجامد.
در محاسبه ی آسیب بافتی، کمیت پرتوتابی با رونتگن (R) یا سانتی گری (cGy) بیان می شود. رونتگن واحد مواجهه (exposure) و سانتی گری واحد دوز جذب شده است. در مورد پرتوهای x و y مواجهه به اندازه یک رونتگن (1R) به میزان جذبی معادل یک سانتی گری (1cGy) منجر می شود. برای سالها راد (rad) به عنوان واحد پرتو جذب شده در نظر گرفته می شد، بویژه وقتی پزشکان در مورد پرتوتابی خارجی (external) بحث می کردند. یک راد معادل صد ارگ (100ergs) در گرم انرژی جذب شده توسط بافت است. در حال حاضر گری (gray) در سراسر جهان و در انتشارات علمی و حرفه ای بکار می رود (1Gy=100rad=100cGy).
اگر چه تغییرات گوناگون موفولوژیک و عملکردی (functional) در سلولهای پرتودیده شرح داده شده است، لیکن شواهد عینی و استنباطی حاکی از آن است که آسیب هسته سلول بیشترین نقش را در مرگ سلولی دارد. طبق محاسبات انجام شده 1x10به توان6 cGy برای آسیب دیواره سلول لازم است، حال آنکه اختلالات کروموزومی و جهش ممکن است در دوزهای پایین تر پرتو بوجود آیند. از آنجا که فقط چند صد سانتی گری برای کشتن سلولهای در حال تزاید لازم است. منطقی به نظر می رسد که تغییرات هسته ای حاصل از دوزهای پایین مسوول مرگ سلول باشند.
آثار پرتو بر چرخه سلولی
سلولهای بدن پستانداران در یک زمان در فازهای مختلف چرخه سلولی قرار دارند. اجزای چرخه سلولی عبارتند از
G2, S, G1 و M که به ترتیب بیانگر فاز پیش سنتتیک (Presyntheic) سنتز DNA، فاز پس سنتتیک (postsynthetic) و میتوز هستند. تجزیه و تحلیل کمپارتمانی (compartmental) چرخه سلولی مبتنی بر مشاهده رویداهای مرفولوژیک داخل سلولی مبتنی بر مشاهده رویدادهای مرفولوژیک داخل سلول است. اول روند میتوز است. در یک جمعیت مناسب در حال رشد تصاعدی از سلولهای پستانداران که به طور مناسبی رنگ آمیزی شده باشند، می توان نسبت میتوز را محاسبه کرد و اندکس میتوتیک (mitotic index) را که عبارتست از نسبت سلولهای در حال میتوز به کل سلولها را بدست آورد. در بسیاری از سلولهای پستانداران، اندکس میتوتیک بین 2 تا 7 درصد است. دوره دوم [در چرخه سلول] دوره سنتز DNA است. برای تخمین نسبت سلولهایی که در مرحله سنتز DNA هستند، سلولهای در حال رشد تصاعدی در معرض یک پیش شاز DNA که با ایزوتوپ مناسب نشاندار شده
است قرار می گیرند. در طی مواجهه کوتاه مدت، سلولها با پیش ساز نشاندار شده، فقط سلولهایی که درحال رپلیکاسیون DNA هستند ماده مذکور را برداشت کرده و قابل تشخیص می باشند. اندکس سلولهای نشاندار که عبارتست از نسبت سلولهای در حال سنتز DNA حدود 50 تا 60 درصد است.
درک اصول رشد سلول از اهمیت خاصی برخوردار است. در جمعیت سلولهای در حال رشد تصاعدی، نسبت سلولها در هرکدام از اجزای چرخه سلولی ثابت است. نسبت سلولها در هر کدام از اجزای چرخ سلولی تقریباً متناسب با زمان لازم جهت تکمیل شدن فعالیت ویژه سلول در آن مرحله است. بین هر تقسیم، رویدادهای ماکرومولکولی مهمی اتفاق می افتد و تخمین دقیق از [هرکدام از اجزای] چرخ سلولی با تکنولوژی جدید به سرعت انجام می شود.
با مطالعات رادیوبیولوژیکی جنبه های اشکال گوناگونی از حساسیت به پرتو (radiosensitivity) شناخته شده است. هنگامی که سلولها درحال طی روند سنتز DNA هستند، بیشترین مقاومت به پرتو را از خود نشان می دهند. زمانی که سلولها در فاز G2 یا میتوز هستند، بیشترین حساسیت را به پرتو دارند. اگر فاز G1 کوتاه باشد سلولها در این مرحله به پرتو حساس هستند و بالعکس در صورتی که فاز مذکور طولانی باشد ممکن است افزایش مقاومت به اشعه دیده شود.
پرتوتابی را باید عاملی دانست که برچرخه سلولی تاثیر ویژه ای دارد. به نظر می رسد که پاسخ سلولهای برخی تومورهای انسانی به پرتوتابی به فازهای مختلفی که سلولهای تومور در چرخه سلولی دارند وابسته است. پاسخ بافت طبیعی زمینه نیز به عوامل کینتیک مشابهی وابسته می باشد.
اثر اکسیژن
اکسیژن مولکولی بر مواجهه سلولهای طبیعی و نئوپلاستیک با پرتو تاثیر داشته، اثر اکسیژن در زیست شناسی پرتوتابی( radiation biology) از اهمیت ویژه ای برخوردار است. اکسیژن به عنوان یک حساس کننده به اشعه (radiosensitizer) اثر می کند و سلولها را برای آثار مرگبارپرتو مستعدتر می کند. بالعکس، سلولهای هیپوکسیک ممکن است به پرتو مقاوم باشند. موضوع سلولهای هیپوکسیک در بافت نئوپلاستیک انسان ممکن است در پرتودرمانی دست کم دو نوع تومور دستگاه تولید مثل زنان اهمیت داشته باشد. در کارسینوم پیشرفته گردن رحم، امکان کنترل موضعی بیماری لگن به وسیله پرتوتابی خارجی ضعیف است که ممکن است در اثر وجود تعداد زیادی سلولهای توموری هیپوکسیک باشد. زنان مبتلا به کارسینوم تخمدان که با آسیت مراجعه می کنند با استفاده از عوامل شیمی درمانی و پرتوتابی کل شکم پس از پاراسنتز (paracentesis) و برداشتن توده به وسیله جراحی به شیوه موثرتری درمان می شوند. مشخص نیست که آیا شیوه های موثرتری درمان می شوند.مشخص نیست که آیا شیوه های فوق الذکر در درمان تاثیر دارند یا برداشتن تعداد زیادی سلول هیپوکسیک از محل تومور موثرتر هستند که سلولهای تومور به خوبی اکسیژنه شده و حجم تومور کمتر باشد.
اکسیژن در تعیین حساسیت به پرتو نقش مهمی دارد و سلولهای پستانداران 2/5 تا 3/5 برابر در غیاب اکسیژن در مقابل پرتو مقاوم تر هستند. تفاوت فوق enhancement ratio اکسیژن نامیده می شود. اینکه آیا اثر فوق امکان کنترل موضعی تومورهای بزرگ انسانی را نیز فراهم می کند هنوز تحت بررسی است، همانطوریکه نقش اکسیژن در تعیین نتایج پرتودرمانی هنوزدر دست مطالعه است.
آثار ژنتیکی
نمی توان میزان جهت خاصی را به میزان پرتو خاصی نسبت داد. لوکوس های ژنی از نظر جهش پذیری (mulability) مشخصاً از یکدیگر متفاوت هستند و آسیب نسبتاً اتفاقی (random) حاصل از پرتو بر کروموزومهای خاص پیش بینی را در این زمینه بسیار مشکل می کند. مرحله میتوز، نوع سلول، جنس، گونه و میزان دوز همه بر میزان جهش در حیوانات پست تر و باکتری ها نقش دارند. داده های به دست آمده در حیوانات پست تر را به سختی می توان درمورد انسان نیز تعمیم داد و پیش بینی درباره جهش را نمی توان براساس داده های بدست آمده از انواع گوناگون مواجه باپرتو انجام داد. شواهد مستقیم در باره جهش حاصل از پرتو در انسان در دسترس نیست. بازماندگان و اعقاب قربانیان حادثه هیروشیما و ناکازاکی هستند. اگر چه هیچ اثر قابل ردیابی در مورد فراوانی مرگ های قبل از تولد و نوزادی و یا ناهنجاری های فرزندان قربانیان در دسترس نیست، اما این بدین معنا نیست که هیچ اثر وراثتی به وسیله پرتو در آنان به وجود نیامده است! تعداد پدر و مادران در معرض پرتو کوچک بوده و دوز پرتو آنقدر کوچک بوده که افزایش جهش تعجب انگیز است. برای بررسی آسیب مغلوب (recessive) باید نسل های متمادی را بررسی کرد.
منطقی به نظر می رسد که مواجهه با پرتو، میزان جهش را در انسان افزایش دهد. چنین انتظاری بیشتر بر مطالعات انجام شده و بر روش ها استوار است. تخمین زده می شود، دوزی که جهش خودبخودی را در انسان دوبرابر می کند بین ده تا صد cGy باشد. در صورت مواجههحاد با پرتو،مقدار احتمالی بین 15 تا30cGYوبرای مواجهه ی مزمن با پرتو حدود صد cGy است. کمیته ژنتیک کمیسیون انرژی اتمی پیشنهاد می کند که هیچ انسانی نباید در طول زندگی در معرض بیش از ده سانتی گری (cGy) پرتو قرار گیرد. با بکارگیری سپرهای محافظ مناسب برای جلوگیری از پخش شدن پرتو، اصلاح فیلم های رادیولوژی و شدت دهنده های تصویر (image intensifier) می توان با میزان مواجهه کمتری از ارگانهای داخلی تصاویر رادیولوژی تهیه کرد. در جدول 2، میزان متوسط دوز پرتو رسیده به جنین و غدد جنسی مادر که در روش های تشخیصی متداول به کار می رود، نشان داده شده است.
جدول 2:دوز متوسط پرتو رسیده به جنین و غدد جنسی مادر در اثر تست های تشخیصی.
|
آزمون
|
دوز رسیده به جنین و غدد جنسی مادر
|
|
گرافی اندام تحتانی
|
1
|
|
گرافی مهره های گردن
|
2
|
|
گرافی جمجمه
|
4
|
|
گرافی قفسه سینه
|
8
|
|
گرافی لگن
|
750
|
|
فلوروسکوپی قفسه سینه
|
70
|
|
کوله سیستو گرافی
|
300
|
|
گرافی مهره های کمری
|
275
|
|
گرافی شکم
|
به ازای هر عکس185
|
|
گرافی هیپ
|
100
|
|
پیلوگرافی داخل وریدی یا رتروگراد
|
585
|
|
گرافی دستگاه گوارش فوقانی
|
330
|
|
گرافی دستگاه گوارش تحتانی
|
465
|
آثار [پرتو] بر جنین
آثار کلاسیک پرتو بر جنین پستانداران عبارتند از اختلال رشد داخل و خارج رحمی، مرگ امبریونیک، جنینی (fetal) و نوزادی، و ناهنجاری های بارز مادرزادی. ساختاری که به آسانی و پیوسته در معرض آسیب است، دستگاه اعصاب مرکزی است، در صورتی که پرتو جذب شده داخل رحمی کمتر از (25cGy) باشد، آثار کلاسیک ذکر شده در حیوانات آزمایشگاهی و همینطور در انسان مشاهده نخواهد شد. دوز جذب شده، مرحله حاملگی و Dose rate در تعیین اثر پرتو بر جنین پستانداران موثرند. آسیب رویانی (embryonic) را می توان با کاهش Dose rate ودر نتیجه فعال کردن روند بهبودی به طرز معنی داری کاهش داد.
ناهنجاری های چشمگیراغلب هنگامی اتفاق می افتند که جنین در مراحل اولیه دوره ارگانوژنز (Organogenic period) باشد، هر چند هیپوپلازی سلول، بافت و حتی ارگان نیز در صورتی که دوز پرتو به حد کافی بالا باشد ممکن است در طی دوران ارگانوژنز، جنینی و نوزادی روی دهد. در تمام مراحل حاملگی مواجهه با 50cGy به احتمال زیاد با آسیب
جنینی همراه است که عبارتند از : مرگ قبل از مرحله لانه گزینی، ناهنجاری در طی مراحل اولیه ارگانوژنز، و حذف سلول ها و هیپوپلازی بافتی در طی مراحل مختلف دوره جنینی. مطالعات حیوانی نشان می دهد که تمام جنین هایی که پس از لانه گزینی درمعرض 100cGy یا بیشتر پرتو قرار گرفته اند درجاتی از اختلال رشد را نشان می دهند. یافتن و تشخیص آثار مخرب ناشی از پرتوتابی در جنین داخل رحم با دوزهای پایین (کمتر از 10cGy) بسیار دشوار است، چرا که بعید است دوزهای کمی چنین آسیبی ایجاد کنند و از طرفی بروز طبیعی چنین ناهنجاریهای زیاد دیده می شود. از نظر بالینی جذب دوز 10cGy توسط جنین در دوره حاملگی به عنوان یک سطح آستانه برای القای نقص مادرزادی در نظر گرفته می شود و در کمتر از این مقدار پرتو، آسیب بسیار کاهش می یابد. از اعمال تشخیصی توسط پرتو x(جدول 2) در دوران حاملگی مگر در موارد اورژانس شدید باید خودداری شود. در زنان سنین باروری برای جلوگیری از آسیب های وارده به جنین در مراحل اول جنینی می توان تست های تشخیصی را بالافاصله پس از شروع دوره قاعدگی انجام داد.
طبقه بندی پرتوهای یونیزان که کاربرد درمانی دارند
پرتوهایی که در پرتودرمانی کاربرد دارند را پرتوهای یونیزان می گویند. این پرتوها را بر اساس ماهیت شان به پرتوهای الکترومغناطیسی و پرتوهای ذره ای تقسیم می کنند. دسته بندی اخیر را می توان بر اساس منشاء و روش تولید به دسته های بیشتری تقسیم کرد. واژه های پرتو x و پرتو y برای پرتوهای الکترومغناطیسی به کار می روند. اگر چه این پرتوها ماهیت یکسانی دارند، تفاوت واژه شناسی این دو از این ناشی می شود که برای تولید پرتوهای x باید از ژنراتورهای مناسب بهره جست ولی پرتوهای y به طور خودبخود از مواد رادیواکتیو که درحال تبدیل (transition) هسته ای هستند آزاد می شوند. استفاده از واژه پرتو x و پرتو y به منشاء پرتو مربوط است نه به انرژی فوتون ها. دراین طبقه بندی بحث درباره ذرات پیچیده است. ذرات مورد بحث عبارتند از پروتون ها، هلیوم، پیون ها (pions)، نوترون ها و یونهای سنگین.
پرتو x زمانی حاصل می شود که الکترونهای سریع به ماده برخورد می کنند. هر دستگاهی که برای تولید اشعه x طراحی شده است باید دارای منبعی از الکترون ، روشی برای شتاب بخشیدن به الکترون ها (بکارگیری ولتاژ بالا، شتاب دادن با یک شتاب دهنده خطی)، و هدفی که الکترون ها با آن برخورد کنند تا پرتو x تولید شود، باشد.
اتم های مواد رادیواکتیو ناپایدار (unstable) بوده، به طور خودبخودی دچار تخریب رادیواکتیو می شوند که در نتیجه آن پرتو چه به صورت امواج الکترومغناطیس (فرتون ها) و چه ذرات به هر دو صورت امواج الکترومغناطیس (فوتون ها) و چه ذرات به هردو صورت تولید می شود. یک مثال، استفاده پزشکی از emission ایزوتوپ رادیواکتیو در کبالت 60(60Co) دیده می شود که در ماشین های درمان از دور (Teletherapy) به کار می رود. یک مثال برای منبع آزاد سازی ذرات در پزشکی فسفر رادیواکتیو (35p) است که از خود ذرات b آزاد می کند که همان الکترونها هستند.
اصول پرتودرمانی
مدالیته های (modalities) درمانی به کار رفته در پرتودرمانی به دو نوع پرتوتابی خارجی و موضعی تقسیم می شوند. پرتوتابی خارجی عبارتست از انرژی تابشی که از یک منبع فاصله دار از بدن به وجود آمده باشد (برای مثال 60Co، شتاب دهنده خطی، بتاترون (betatron)، ماشین های استاندارد پرتو x ارتوولتاژ orthovoltage، پرتوتابی موضعی به انرژی تابشی از منبعی در نزدیکی تومور گفته می شود. مثال موضوع اخیر پرتوتابی داخل حفرات به وسیله اپلیکاتورهایی است که حاوی مواد رادیواکتیو همچون رادیوم یا سزیوم هستند (برای مثال اووئیدهای (Ovoids) واژن، سیلندرهای واژن)، پرتوتابی بینابینی (interstial) معمولاً بصورت سوزن های قابل برداشت حاوی رادیوم، سزیوم یا ایریدیوم است و پرتوتابی مستقیم (برای مثال پرتوتابی ترانس واژینال ) معمولاً به وسیله مخروط هایی از ماشین ارتوولتاژ انجام می شود.
پرتوتابی خارجی
با کاهش طول موج فوتون، انرژی و قدرت نفوذی پرتو یونیزان افزایش می یابد. تفاوت های بین خصوصیات فیزیکی پرتوهای به کار رفته در رادیولوژی درمانی از اهمیت ویژه ای برخوردار است.تغییرات مهم از نظر بالینی به وسیله پرتوهایی ایجاد می شوند که در محدوده 400 تا 800 کیلوولت هستند (جدول 1). مزایای انرژی بالاتر از این عبارتند از کاهش جذب پرتو به وسیله استخوان، آسیب کمتر به پوست درمحل ورود پرتو، تحمل بیشتر به وسیله بافت عروقی همبندی، پرتوهای بیشتر در عمق در مقایسه با سطح، و پخش شدن طرفی کمتر اشعه در بافت.
پرتوتابی های سوپرولتاژ در مقایسه با ارتوولتاژ آثار کمتری بر پوست دارند. در پرتوتابی سوپرولتاژ انرژی بیشتری تولید شده و پراکنده شدن به سمت جلو (در جهت پرتوهای اولیه) در محل جذب پرتو بیشتر و پراکندگی پرتو به اطراف کاهش می یابد. با پرتوتابی سوپرولتاژ بیشترین یونیزاسیون در سطح زیر اپیدرم اتفاق می افتد. برای مثال با درمان از دور توسط 60Co حداکثر یونیزاسیون در حدود پنج میلی متر زیر سطح اتفاق می افتد و دوز رسیده به سطح ممکن است فقط 40% از این حد ماکزیمم باشد.
منحنی ایزودوز (isodose) خطی است که نقاطی در بافت را که دوزهای مساوی از پرتو دریافت می کنند را به هم وصل می کند. شکل 6-53 منحنی ایزودوز برای 60Co در 22-MeV و ماشین 220MeV را باهم مقایسه می کند. برای ماشین 60Co دوز حداکثر نزدیک به سطح است (0/5 سانتی زیر پوست) و افت انرژی هم در مقایسه با ماشین 22-MeV که حداکثر دوز آن درست زیر سطح است، (4cm) بوده افت انرژی آن تدریجی است. سریعتر است. در یک عمق مشخص، بوسیله ماشین MeV-22 به دوز بالاتری از پرتو می توان دست یافت، البته بدون در نظر گرفتن اثر پرتو در پوست و بافت زیر پوستی، این ماشین های با انرژی بالا به ویژه برای درمان تومورهای عمقی و افراد چاق مناسب هستند.
با افزایش انرژی پرتوتابی، قدرت نفوذ آن هم افزایش می یابد. با افزایش انرژی فوتون ها و به تبع آن الکترونها مسافت بیشتری را در ماده جذب کننده طی می کنند. درصد پرتوتابی به ویژه در عمق بافت در مقایسه با دوز سطحی با افزایش انرژی افزایش می یابد. مزیت اخیر سوپوولتاژ و مگاولتاژ در اهمیت بالینی آنها در درمان تومورهای موجود در عمق ارگانیسم است(مثل کار سینوم مثانه و گردن رحم). در چنین مکانهایی با بکارگیری دوز سطحی به وسیله ارتوولتاژ مشکل و غیر ممکن است.
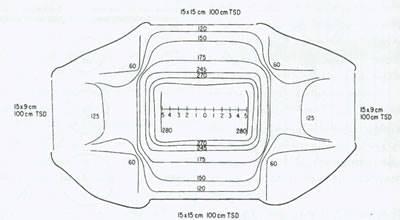
شکل 7:منحنی های ایزودومر از یک برنامه دومیدانی به وسیله یک شتابدهنده خطی
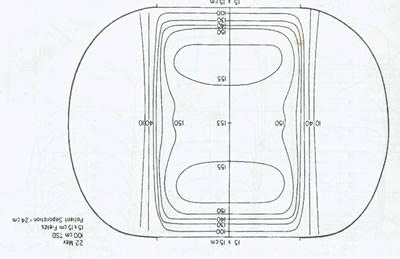
شکل 8. منحنی ایزودومر از یک الگوی درمانی چهار میدانی روی یک ماشین 22-MeV TSD، فاصله تومور-منبع
لیکن، در عمل در پرتودرمانی در طب زنان از تکنیکهای دو یا چهار میدانی استفاده می شود. مزیت استفاده از تکنیک دو میدانی یا "موازی مخالف" لگن سادگی آن است و از آنجا که حاشیه های طرفی کافی [برای پرتوتابی] وجود دارد، تغییرات جزیی در دوز روزانه تفاوتی در دوز رسیده به بافت هدف ایجاد نمی کند. در شکل 7 منحنی های ایزودوز درمان موازی و مخالف (opposed) درمان لگن با استفاده از یک دستگاه MeV22 آمده است. توجه کنید که در روش اخیر بافت های طبیعی اطراف در قدام و خلف در معرض پرتو کمتری قرار دارند و دوز لازم برای درمان به مرکز لگن (central pelvis) می رسد.
تکنیک چهارمیدانی (four fields) اصطلاحاً تکنیک جعبه خوانده می شود و برای کاهش دوزهای زیرپوستی (subcutaneous) و میزان بافت طبیعی در معرض دوز بالای پرتو به کار می رود. برای بیماری با فاصله قدامی خلفی 24 انتی پرتو به کار می رود. برای بیماری با فاصله قدامی خلفی 24 سانتی متر حجمی معادل 6000cc پرتوی به میزان تجویز شده (مثلاً 500cGy) در میدانهای موازی و مخالف به کار می رود، اما با برنامه درمانی چهار میدانی حجم مذکور به حدود 3500cc کاهش می یابد. اگر چه حجم کال بافت طبیعی پرتو دیده با میزانی از پرتو در روش چهارمیدانی بیشتر است،
پخش شدن پرتو در این روش واکنش بافت طبیعی را کاهش می دهد. نیاز به درمان تمام میدان ها به صورت روزانه به دفعات در مقالات مطرح شده است. شکل 8 منحنی های ایزودوز تکنیک چهارمیدانی با استفاده از دستگاه MeV-22 را نشان می دهد.
در محدوده ی سوپرولتاژ میزان جذب پرتو به وسیله استخوان تقریباً مثل جذب توسط آن و بافتهای نرم است، اما در محدوده ارتوولتاژ جذب توسط استخوان بیشتر از بافت نرم است. بافت عروقی همبندی چسبیده به استخوان اطراف مجاری هاورس دوز بیشتری از پرتو را به خاطر استاتیک بودن آن دریافت می کنند. دوز بیشتر جذب شده فوق به علت تخریب عناصر استئوبلاستی و آسیب سیستم عروقی خطر نکروز استخوان را افزایش می دهد. با افزایش انرژی پرتو می توان آثار مشابهی بر تومور بوجود آورد، بدون آنکه بافت های طبیعی اطراف آسیب ببینند. به علاوه بروز آسیب مخاطی و پوستی نیز کاهش می یابد و بافت های عروقی همبندی هم کمتر آسیب می بینند. خاصیت تحمل بالای بافت های همبندی عروقی به دوز بالای پرتو توسط پرتوتابی سوپرولتاژ از عواملی است که امکان درمان همراه پرتودرمانی و جراحی را بدون افزایش ریسک جراحی (البته به جز عوارض جراحی به تنهایی) را فراهم می کند.
پرتوتابی موضعی
بکارگیری موضعی پرتوتابی امکان انتقال دوز بالایی از پرتو را به منطقه محدودی از بافت فراهم می آورد. میزان بالای درمان در طب زنان در نتیجه دسترسی به سرطانهای واژن و رحم در اثر پرتوتابی موضعی است. به واسطه این دسترسی ی توان دوز نسبتاً بالایی از پرتو را به نئوپلاسم رسانید، در حالی که بافت های طبیعی اطراف در معرض دوز ایمنی از پرتو قرار می گیرند.
صرفنظر از منبع پرتو که ممکن است الکترومغناطیس یا فوتون باشد، میزان انرژی انتقال یافته با افزایش فاصله از منبع دچار واگرایی می شود. این واگرایی باعث کاهش انرژی شده و رابطه فوتون با قانون مجذور معکوس که عبارتست از کاهش دوز پرتو در هرواحد به نسبت مجذور فاصله از منبع انرژی تعریف می شود. برای مثال، دوز پرتو در نقطه ای با فاصله دو سانتی متر از منبع فقط یک چهارم میزان آن در یک سانتی متری است. دوز عمقی (درمقایسه با دوز سطحی) با بکارگیری Ovoid های واژینال بزرگتر همراه با براکی تراپی کانسر سرویکس افزایش می یابد. در این وضعیت، قانون معکوس مجذور یعنی کاهش شدت پرتو متناسب با افزایش فاصله موثر واقع می شود.
پرتوتابی موضعی برای تومورهای کوچک با حاشیه های مشخص که از لحاظ بالینی محدوده کوچکی باید تحت
پرتوتابی قرار گیرد، مناسب است. برای پرتوتابی حجم بزرگتری از بافت بهتر است ازپرتوتابی خارجی استفاده شود. در گذشته، از ایزوتوپ رادیوم در لوله ها (tubes) و سوزن ها (needles) به صورت موضعی در دستگاه تناسلی استفاده می شود. تنها نکته منفی مواد دردسترس کنونی (جدول 4)، نیمه عمر کوتاه آنهاست. بسیاری از این مواد را می توان به مواد جامدی چون سرامیک و فلزهای مختلف اضافه کرد و دیگر نیاز نیست مثل رادیوم به صورت پودر یا گاز به کارگرفته شوند. لوله ها و سوزن های رادیوم حاوی پودر رادیوم هستند و بسیاری از مشتقات حاصل از تلاشی آن به صورت گاز در داخل همان محفظه ها قرار دارند. بنابر علل فوق، در اکثر موسسات سزیوم جایگزین رادیوم شده است.
جدول 4:ایزوتوپ هایی که معمولاً در پرتو درمانی کاربرد دارند.
|
ایزوتوپ
|
انرژی (MeV )
|
نیمه عمر
|
|
137CS
|
0/662
|
30 سال
|
|
50cO
|
173/11
|
3/5 سال
|
|
125I
|
35 0/0-27 0/0
|
60 روز
|
|
192 Ir
|
47 /0
|
74 روز
|
|
226Ra
|
8 /0
|
1620 سال
|
|
222RN
|
8/0
|
83/3 روز
|
|
182 Ta
|
8/0
|
115 روز
|
در گذشته طلای 198 (Au198) برای کاشتن (implant) دائمی در تومور به کار می رفت. آماده سازی آن دشوار بود و به سرعت رادیواکتیویته آن دچار فساد می شد و در نتیجه دستیابی به یک دوز همگون (homogenous) دشوار بود. در حال حاضر ید 125(125I) جایگزین طلای 198 برای کاشتن در تومور شده است.
در صورتی که شدت پرتو با افزایش عمق بافت کاهش پیدا کند، همانطور که در پرتوتابی موضعی دیده می شود، از نظر تئوری بافت نزدیک به منبع پرتو ممکن است بدون آسیب به بافت های اطراف درمان شود. موثر بودن توزیع پرتو به این شیوه، بستگی زیادی به چگونگی بکارگیری منبع پرتو به این شیوه، بستگی زیادی به چگونگی بکارگیری منبع پرتو دارد. بکارگیری بینابینی (interstitial )منبع رادیواکتیو از بکارگیری داخل حفره ای آن مشکل تر است. بکارگیری منابع متعدد برخلاف تاباندن پرتو از یک منبع خارجی و یا منبع داخل حفره ای تاباندن پرتو از یک منبع خارجی و یا منبع داخل حفره ای با جاگذاری صحیح اغلب به یک الگوی با همگونی کمتر (less homogenous) می انجامد. از طرفی بافت های در معرض خطر ممکن است پرتو بیشتری ببینند.
درمان بینابینی عبارتست از استفاده از سوزنهای سزیوم یا ایریدیوم که در بافت تومور کاشته می شود. به علت میزان بالای پرتو در اطراف منبع، برای پوشش دادن یک حجم بزرگ معمولاً به تعداد زیادی منبع پرتو نیاز است. منحنی های ایزودوز را می توان برای چنین ایمپلانت هایی رسم کرد ایمپلانت های سوزنی را اغلب برای انتقال دوز بالای موضعی در ضایعات واژن به کار می برند. استفاده از tempate واژینال باعث شده تا ایمپلانت سوزنی رادیواکتیو در منابع طرفی ضایعات گردن رحم و واژن استفاده بیشتری شود (شکل10).
پرتوهای یونیزان در درمان بیماریهای زنان
استفاده از پرتوهای یونیزان در طب زنان عملاً به درمان بدخیمی ها محدود می شود. درگذشته نه چندان دور، از پرتوتابی برای عقیم سازی (sterilization)، برای درمان خونریزی dysfunctional یا climacteric، برای انجام
تخمک گذاری در موارد عقیمی و برای درمان بیماریهای اگزمایی و دیگر بیماریهای فرج (vulva) استفاده می شد. در زنان قبل از سن یائسگی یک دوز واجد 400 تا 500 سانتی گری برای قطع دائمی قاعدگی کفایت می کند، ولیکن یک دوز 1200 تا 2000 سانتی گری در ده روز تا دو هفته برای قطع کامل تولید استروئیدها در افراد جوانتر کافی است. در حال حاضر نیز در برخی موارد از جمله بیماران مبتلا به منوراژی شدید که مناسب جراحی نیستند، از جمله زنان قبل از یائسگی و زنان مبتلا به لوسمی حاد به همراه ترومبوسیتوپنی و منوراژی کاربرد دارد. به هر حال در حال حاضر به جز موارد یاد شده بالا تمام شرایط خوش خیم با روشهایی غیر از پرتوتابی درمان می شوند.
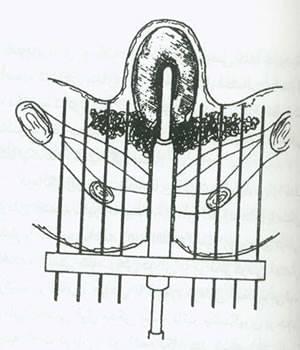
شکل 10:دیاگرام یک کاشت بینابینی برای درمان سرطان سرویکس مرحله iiibبا یک اپلیکاتور seyed-Noblett
تولرانس ارگانهای لگنی
تحمل اندام های داخل لگن به پرتو در بیماران مختلف تفاوت اندکی داشته،به عواملی همچون حجم fractionation و انرژی رادیواکتیو دریافتی که قبلاً ذکر شد بستگی دارد. بکارگیری ایزوتوپ ها از طرق مختلف نیز ممکن است باعث توزیع متفاوت پرتو شده، تفاوت قابل ملاحظه ای در تحمل اندام ها ایجاد کند. هرچه ضایعه پیشرفته تر باشد به دوز بیشتری برای ریشه کن کردن آن نیاز است و میزان از کار افتادگی (morbidity) نیز افزایش می یابد. در بیماری پیشرفته، خطربالای آسیب ثابت شده است. در سرطانهای پیشرفته گردن رحم، واژن و corpus یکپارچگی (integrity) مثانه و رکتوم ممکن است دچار اختلال شده باشد و ریشه کنی چنین ضایعاتی ممکن است عوارض غیر جدی در پی داشته باشد.
گردن کورپوس رحم توان تحمل دوزهای بالای پرتو را دارند. بافت های مذکور در مقایسه با هر بافت دیگری در بدن با همان حجم مساوی دوز بیشتری از پرتو را تحمل می کنند. دوزهای 20000 تا 30000 سانتی گری در دو هفته به راحتی تحمل می شود. سطح قابل توجه فوق امکان بکارگیری میزان بالای پرتو برای کنترل سرطان گردن رحم را فراهم می کند. تحمل غیر معمول بافت های رحم و واژن به پرتو باعث موفقیت درمان ضایعات گردن رحم با رادیوم و سزیوم است. علاوه بر تحمل بافتی به نظر می رسد اپی تلیوم و رحم و واژن توانایی قابل توجهی در بهبودی آسیب ناشی از پرتو دارند.
در مقایسه با دیگر اندام های موجود در لگن به جز روده ی کوچک، سیگموئید، رکتوسیگموئید و رکتوم، حساسیت بیشتری به آسیب ناشی از اشعه دارند. فراوانی دفعات مواجهه بیشتری به آسیب ناشی از اشعه دارند. فراوانی دفعات مواجهه با پرتو در روده بزرگ اغلب به نزدیکی آن با ایزوتوپ به کار گرفته شده، دوز کلی به کار گرفته شده برای درمان و توسط پرتوی خارجی یا داخل حفره ای بستگی دارد. درصورت استفاده از پرتوی خارجی به تنهایی، روده بزرگ حساس ترین ساختاری به پرتوتابی خواهد بود. واکنش حاد زودرس به پرتو با اسهال و زورپیچ (tenesmus) مشخص می شود. یکی از تظاهرات دیررس آسیب که پس از 6 تا 12 ماه پس از درمان دیده می شود عبارتست از درد مزمن لگن به همراه تنگی لومن روده و انسداد نسبی. حداکثر دوز قابل تحمل به وسیله رکتوم به عوامل متعددی از جمله زمان و دوز بکارگرفته شده پرتو خارجی و منبع موضعی ایزوتوپ بستگی دارد. براساس محاسبه kottmeier دوز رسیده به مثانه و رکتوم از طریق تکنیک استکهلم در بکارگیری رادیوم داخل حفرات از طریق تکنیک استکهلم در بکارگیری رادیوم داخل حفرات حدود 4000 سانتی گری در سه سانتی متر مکعب رکتوم و مثانه می باشد.
براساس بیشتر بررسی ها مثانه مختصراً تحمل بیشتری نسبت به رکتوم در مقابل پرتو دارد. براساس یک قانون سرانگشتی (rule to rhumb) یا fletcher پیشنهاد کرده حدود بالای پرتوتابی مطرح شده و به طور غیر مستقیم تحمل مثانه و رکتوم به این صورت تخمین زده می شود: مجموع دوز مرکزی توسط پرتو خارجی به اضافه تعداد میلی گرم ساعت (mgh) رادیوم و سزیوم به کار رفته توسط تکنیک های داخل +1142
حفره ای نباید از 10000 تجاوز کند. البته موضوع فوق فقط در صورتی که از دستگاه داخل حفره ای fletcher-suit استفاده شود صدق می کند. در صورتی که دوز بالایی از رادیوم یا سزیوم به صورت داخل حفره ای برای یک ضایعه کوچک به کار رود میزان پرتو خارجی به کار رفته باید حداقل مقدار ممکن نگهداشته شود. بالعکس در صورتی که ضایعه بزرگ باشد و الگوی ساختاری واژن نیز مناسب نباشد می توان از یک دوز داخل حفره ای حداقل و دوز مرکزی خارجی (external) بسیار بالا (7000cGy- 6000) استفاده کرد.
از آنجا که پرتوتابی کارسینوم گردن رحم مقدمتاً با هدف محتویات لگن انجام می شود، فقط قسمت های محدودی از روده کوچک درگیر می شوند. درمان طبیعی روده کوچک حرکت ثابتی دارد و همین موضوع باعث می شود که قسمت های مختلف روده در معرض پرتوی زیاد قرار نگیرد.
درصورتی که در اثر جراحی قبلی لگن لوپ هایی از روده کوچک دچار چسبندگی شده باشند، ممکن است قسمتی از روده که مستقیماً در معرض پرتو قرار گرفته آسیب ببیند. آسیب حاصل معمولاً پس از یک سال یا بیشتر از تکمیل پرتوتابی علامت دار می شود و به صورت تنگی لومن به همراه یا بدون زخم مخاطی تظاهر می کند.
آسیب وارده به بافت طبیعی ممکن است دائمی باشد. هنگامی که ناحیه ای از بدن در معرض دوزهای مخرب تومور قرار گیرد، بافت های طبیعی اطراف دچار آسیب شده به ترتیبی که حتی اگر بیمار تا چندین سال زنده بماند بافت های مذکور فقط تا حدی ترمیم می شوند. براساس تخمین رادیوبیولوژیست ها فقط 5 تا 20 درصد از بافت های طبیعی آسیب دیده ترمیم می شوند. بافت های طبیعی اطراف تومور پرتودیده تا حد قابل توجهی باعث معلولیت بیمار می شود اما در صورتی که بیمار بار دیگر دچار بدخیمی در همان ناحیه شود، پرتوتابی اضافی ممکن است آسیب غیر قابل قبول به بافت های طبیعی اطراف وارد کند. عموماً لازم است همان ناحیه مجدداً برای تخریب تومور پرتوتابی نشود، چرا که نتیجه حاصله، از بین رفتن وسیع بافت طبیعی در آن ناحیه خواهد بود.
طرح درمان
تجویز پرتودرمانی به عوامل بسیاری بستگی دارد. پزشک معالج باید بیمار را از هرجهت از جمله لمس، تصویر برداری، و ملاحظات جراحی بررسی کند. خصوصیات آسیب شناختی بیماری از جمله مناطق احتمالی متاستاز که ممکن است درمان را تحت تأثیر قرار دهد باید در نظر گرفته شوند. یک مثال به کارگیری پرتودرمانی انتخابی لنفاتیک های ناحیه لگن است.
درمانگر [براساس یافته های ذکر شده] باید درباره هدف درمان تصمیم بگیرد که بیمار را درمان کند (Cure) یا مشکل بیمار را تسکین بخشد (palliation)، باید روش های درمانی مختلف بررسی شود. روش درمان با در نظر گرفتن احتمال ترکیب پرتوتابی،جراحی یا شیمی درمانی انتخاب می شود. درمان انتخابی فوق ممکن است تاثیر چشمگیری بر حجم ناحیه تحت درمان و دوز اشعه بکار رفته باشد. تعیین دوز بهینه پرتو و حجم تحت درمان به موقعیت آناتومیک، نوع تومور از نظر بافت شناسی، مرحله (stage) و دیگر خصوصیات تومور و همچنین بافت طبیعی اطراف تومور بستگی دارد.
سرطان شناس مسؤول پرتودرمانی باید همکاری نزدیک با متخصص زنان داشته باشد تا روش های درمانی گوناگون را بررسی کند. فیزیکدانان هم در تعیین طرح درمان و دوزیمتری (dosimetry) برای اطمینان حاصل کردن از دقت درمان نقش موثری دارند. ارزیابی دوره ای از وضعیت عمومی بیمار، پاسخ تومور به درمان و وضعیت بافتهای طبیعی در طی درمان ضروری است. تصمیم نهایی برای انجام پرتودرمانی با سرطان شناس پرتودرمان است.
درمان پذیری توسط پرتو (radiocurability)
درمان پذیری توسط پرتو اغلب با حساسیت پرتو (radiocurability) اشتباه می شود. درمان پذیری عبارتستاز ریشه کن کردن تومور از جایگاه اولیه و مناطق اطراف توسط پرتو در حالی که حساسیت به پرتو به پاسخ تومور به پرتو گفته می شود و ربطی به درمان ندارد. حساسیت یک ضایعه بدخیم به پرتو به عوامل بسیاری بستگی دارد که از آن جمله میزان هیپوکسی، نسبت سلولها در چرخه سلولی، حساسیت ذاتی تومور به پرتو، و کارایی مکانیزم های ترمیمی آسیب سلولی ناشی از پرتو را می توان نام برد. بیشتر تومورهایی که به درمان پاسخ نمی دهند، قسمت های هیپوکسیک زیادی داشته، توان اکسیژناسیون مجدد در طی پرتوتابی را ندارند. مقاومت به پرتو به علت هیپوکسی در مدل های تجربی بررسی شده است ولی آزمون های بالینی طراحی شده برای
برطرف کردن هیپوکسی تاکنون نتایج موفقی نداشته اند. ترمیم آسیب های مخرب (subethel) در اکثر رده های سلولی تومورها دیده می شود. آسیب های بالقوه کشنده از یک رده به رده دیگر سلولی متفاوت است و به نظر می رسد که با درمان پذیری بالینی تومور ارتباط مستقیم داشته باشد و سلولهایی که درمان پذیری کمتری دارند بیشترین بهبودی از حالت بالقوه کشنده (sublethal) را از خود نشان می دهند. ارتباط خاصی بین پاسخ دهی تومور به پرتوتابی ودرمان پذیری وجود ندارد و ضایعات به نسبت، مقاوم به پرتو و قابل درمان در بسیاری از انواع تومورها دیده می شود.
سرطان گردن رحم
انجام پرتوتابی خارجی لگن در سرطان رحم به چند دلیل کار مقعولانه و قابل قبولی است. از آنجا که رادیوم و سزیوم درون حفره ای از قانون عکس مجذور پرتوهایی که از ایزوتوپ های رادیواکتیو منتشر می شوند تبعیت می کنند، نمی توانند در فاصله ای بیش از سه سانتی متر از دهانه خارجی گردن رحم دوز ضد سرطانی مطمئنی را رها سازند. به علاوه باید گذشته از رحم، بخش فوقانی واژن و بخش های داخلی رباط پهن (broad ligament) ساختارهایی مانند: بخش جانبی رباط پهن، رباط های رحمی خارجی (uterosacral)، رباطهای رحمی - مثانه ای و گره های لنفاوی لگنی را نیز باید جزء محدوده وسیع سرطان رحمی و نیز درمحدوده درمانی در نظر گرفت. حساسیت ساختارهای مجاور مانند روده و مثانه، میزان رادیوم درون حفره ای را که می توان با اطمینان خاطر استفاده کرد، محدود می نماید. با وجود مقاومت بی نهایت زیاد بافت طبیعی رحم و واژن به پرتوها باید درباره مقدار و کمیت رادیوم درون حفره ای محدودیت هایی قایل شد و به این ترتیب پرتوتابی خارج لگنی به عنوان تنها روشی که قادر است دوز موثری را به طور یکسان به حجم بزرگی از بافت در معرض خطر بتاباند مطرح می باشد.
در درمان سرطان گردن رحم، ترکیب دقیق و محتاطانه پرتوتابی خارجی و کاربرد درون حفره ای رادیوم یا سزیوم نقش سرنوشت سازی دارد. درباره ضایعات مرحله IB که وجود متاستاز منطقه ای پیداست، می توان از رادیوم درون حفره ای به تنهایی استفاده کرد که کلاً 10000mgh را در دو دوز منقسم به روش fletcher آزاد می سازد. برای ضایعات مرحله III، به ویژه در افرادی که الگوی ساختاری واژن آنها امکان استفاده از رادیوم را فراهم نمی آورد، پرتوتابی خارجی ممکن است جزء اصلی برنامه درمان باشد و از پرتوتابی کل لگن با دوز شش تا هفت هزار cGy نیز می توان استفاده کرد. توزیع بیماری را باید به وسیله لمس و روشهای تشخیصی ارزیابی نمود و کاربرد درون حفره ای رادیوم و پرتوتابی خارجی باید با چنان دقتی همراه باشد که بیشترین دوز بطور مسقتیم به تومور تابیده، میزان عوارض و از کارافتادگی (morbidity) به حد قابل قبولی برسد.
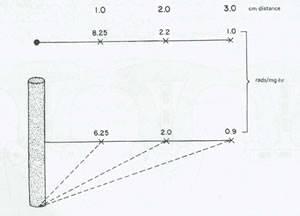
شکل 11:رادیاسیون در فواصل مختلف از یک منبع نقطه ای 1mgرادیوم و منبع لوله ای 1mg ،2-cmرادیوم.
اهداف درمان عبارتند از : عقیم سازی ضایعه مرکزی و تخریب سلولهای [نئوپلاستیک] در بافت های اطراف رحم و گره های لنفاوی منطقه ای، پرتوتابی خارجی عمدتاً خارجی عمدتاً به عنوان گام نخست در تخریب متاستاز به گره های لنفاوی جانبی و در جهت کاهش اندازه ضایعه مرکزی به کار می رود. کاهش اندازه ضایعه مرکزی از آن جهت مطلوب است که اثر جانبی منبع ایزوتوپی مرکزی از آن جهت مطلوب است که اثر جانبی منبع ایزوتوپی برحسب مجذور فاصله از بین می رود. هرچه گردن رحم کوچکتر باشد، اثر ایزوتوپ بر اطراف گردن رحم بیشتر است. کاربرد پرتوتابی خارجی قبل از درمان موضعی امکان بهبود و ترمیم ضایعات شدیداً عفونی گردن رحم و تحلیل ضایعات قارچ مانند (اگزوفیتیک) را که مانع جایگیری صحیح وسایل درون حفره ای می شوند فراهم می آورد.
پژوهشگران بریتانیایی به منظورتعیین میزان کمی مقدار پرتوپی که به برخی مناطق لگن می رسد، همزمان با تکمیل سیستم manchester(به تکنیک های پرتوتابی درون حفره ای نگاه کنید)،نقاط شاخص و کلیدی خاصی را به عنوان نقاط A و B تعیین نمودند. آنها نقطه ای را دو سانتی متر بالاتر از مخاط، در فورنیکس جانبی واژن و دو سانتی متر خارج از مجرای رحمی به عنوان نقطه A و نقطه دیگری را 5 سانتی متر خارجی از مجرا و با استفاده از همان شاخص ها به عنوان نقطه B تعریف کردند. این کار محاسبه دوز رادیوم و اشعه ایکس تابیده شده و دوز جذب شده در مثلث پاراسرویکال یعنی نقطه A و منطقه گره های لنفاوی لگنی (یعنی نقطه B) را امکان پذیر می سازد. پیشنهاد شده است که یک دوز هفت تا هشت هزار cGy برای مهار کارسینوم سلولهای سنگفرشی گردن رحم لازم است و بیشتر کسانی که از سیستم Manchester پیروی می کنند حداقل 7000cGy را برای نقطه A تجویز می کنند. این موضوع، نگرانی درباره جای دادن رادیوم یا سزیوم را کاهش داد، چرا که مطلوب این است که دوز رکتال را در نقطه A در حد 6000cGy نگهداریم که جایگذاری دقیق رادیوم این امر را ممکن می سازد.
تکنیک های پرتوتابی به درون حفرات بدن
تکنیک stockholm
تکنیک stockholm معمولاً به منظور استعمال رادیوم یا سزیوم درون حفرات بدن در سه هفته جدا از هم بکار می رود (شکل 12A). هر بار کاربرد این روش تقریباً 28-25 ساعت طول می کشد و اپلیکاتور درون رحمی حاوی 75-50 میلی گرم ایزوتوپ می باشد. به منظور کاهش احتمال تابش بیش ازحد اشعه به گردن رحم ساختاری مجاور در خط وسط. دو سانتی متر پایین تر از tandem رحمی حاوی هیچگونه رادیومی نیست و گرنه منابع پرتو تابی در سراسر اپلیکاتور رحمی به طور یکنواخت پخش شده اند. اپلیکاتور رحمی به طور یکنواخت پخش شده اند. اپلیکاتور واژینال از جعبه ها و استوانه های متوالی تشکیل شده است. به این ترتیب می توان از دو تا چهار ردیف منبع (پرتوتابی) برای پوشش ضایعات گردن رحم استفاده کرد و معمولاً روی هم رفته 80-60 میلی گرم رادیوم در یک دوره زمانی نسبتاً کوتاه سود می برد. در تکنیک stockholm، دوز (تابش ) در نقطه A به متوسط اندکی کمتر از 6000cGy و دوز نقطه B معمولاً حدود 1900cGy است.
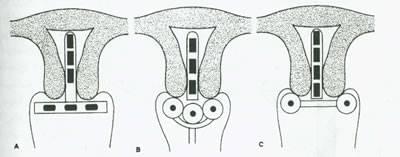
شکل 12.کاربرد در درمان سرطان گردن رحم.(A)تکنیک stockholm(B) تکنیک paris (c) تکنیک manchester
تکنیک paris
بنیاد curie آغازگر تکنیک paris بود (شکل 12B). در این روش از یک tandem رحمی و منابع (تابش) واژینال استفاده می شود. tandem در طول حفره رحمی ادامه یافته و درحالت (تیپیک) کلاً 3 منبع تابش را در بر می گیرد، که منبع موجود در مجرای گردن رحم حاوی 6/6 میلی گرم و در منبع فوقانی تر حاوی 13/3 میلی گرم رادیوم می باشند. می توان یک منبع 10 یا 15 میلی گرمی را جایگزین منبع 13/3 میلی گرمی نمود. در حالت تیپیک دو استوانه چوب پنبه ای، حاوی 13/3 یا 15 میلی گرم رادیوم توسط یک فنر رابط به درون بن بست های جانبی واژن فشرده می شوند و چوب پنبه سوم حاوی 6/6 میلی گرم رادیوم دقیقاً در برابر سوراخ خارج رحم قرار می گیرد. به کمک روش paris دوز (اشعه) در نقطه A مشابه دوز آزاد شده توسط تکنیک MANCHESTER است. در صورت استفاده از میلی گرم ساعت های برابر،این دوز حدوداً 5700cGy طی 6 روز می باشد. یک دوره درمانی 96 تا 200 ساعته، قاعده تکنیک paris است.
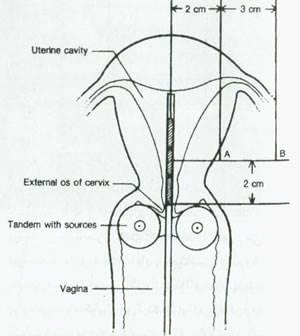
شکل 13:طرح قرار گرفتن بخش tandem وovoid مرغی در سرطان رحم نقاط AوBمشخص شده اند.
تکنیک manchester
تکنیک manchester نوع تغییر یافته مناسب و فراگیری از روش paris است (شکل 12C) و فرق آن با تکنیک Paris در این است که منبع تابشی موجود در مجرای گردن رحم را به عنوان واحد قدرت و بقیه منابع موجود در تنه رحم و واژن را به عنوان مضاربی از این واحد در نظر می گیرند، که در هر بیمار به نحوی برگزیده و تعبیه می شوند که منحنی های ایزودوز برابر و در نقاط مقرر A و B در لگن، دوز بهینه (optimal) تولید کنند (شکل 13). سیستم Manchester بدین منظور طراحی شده است که صرفنظر از اندازه رحم و واژن، الگوهای (ایزودوز) ثابتی فراهم آورد (شکل 14).
سیستم Fletcher-suit، سیستم تعدی شده ای است که به دلیل قدرت تطابق آن با افترلود (پس بار)، با استقبال گسترده ای روبرو شده است. بسیاری از سازمان ها استفاده از رادیوم را کنار گذاشته و در همه اپلیکاتورهای خود از ایزوتوپ ارزان تر (سزیوم) با دوزهای معادل با (رادیوم) استفاده می کنند.
پرتوتابی لگنی خارجی
پرتوتابی به کل لگن معمولاً از میان یک میدان قدامی خلفی به وسعت تقریبی 18-15 سانتی متر مربع انجام می شود (شکل 16). هنگامی که ضایعه، کوچک و مرکزی است، حفظ قدرت تحمل مثانه و (رکتوم) در برابر رادیوم و استفاده از یک قطعه سرب چهار سانتی متر در خط وسط میدان مذکور، عاقلانه است. این تکنیک پرتوتابی پیرارحمی (paranetroid irradiation) نام دارد (شکل17).
تکنیک امکان پرتوتابی یکدست به دیواره لگن و (بافت های) اطراف رحم را فراهم نموده، قدرت تحمل ساختارهای خط وسط را در برابر تکنیک های درون حفره ای آینده حفظ می کند، پرتوتابی سوپرولتاژ یا مگاولتاژ نیز از این مزیت برخوردار است و در صورت امکان باید برای پرتوتابی کل لگن و بافت های اطراف رحم به کار برده شود.
درمان انفرادی و خاص هر بیمار به وسیله کاربرد عاقلانه باریکه پرتوخارجی و پرتوتابی درون حفره ای می توان منجر به میزان بقای رضایت بخشی گردد (جداول 5 و 6). دیگر ملاحظات موثر بر درمان سرطان گردن رحم در فصل 49 مورد بحث قرار گرفته اند.
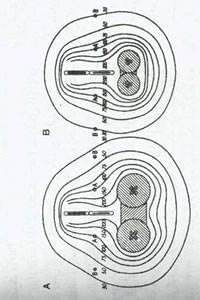
شکل 14:منحنی های همدوز (isodose)در دو مورد که می توان از مقادیر مختلف رادیوم استفاده کرد،دوز آزاد شده توسط تکنیک Manchester را در اعماق مختلف نسان می دهند.در هر یک فدوز در نقطه aصد در صد یا xسانتی گری (cGy) محاسبه می شود.سایر اعداد درصد دوزی را که به سایر اعماق می رسند نشان می دهند (A)اپلیکاتور استاندارد برای یک واژن بزرگ.(B)اپلیکاتور استاندارد برای یک واژن کوچک.دوز در نقاط و با استفاده ازovoid های واژینال بزرگتر بهبود می یابد.با استفاده از های بزرگ تر ،ضمن دستیابی به حداکثر تحمل بافت طبیعی مثانه ،رکتوم و مخاط واژن ،می توان پرتوهای بیشتر به بافت های اطراف رحم تاباند (که در نقاط A وB نشان داده شده است.)
سرطان واژن و فرج
کارسینوم سلول سنگفرشی واژن معمولاً در زنان مسنی که کاندیدای مناسبی نیز برای جراحی نمی باشند، رخ
جدول 5.کارسینوم اپیدرموئید گردن رحم:میزان بقای 5 ساله عاری از بیماری صرفاً توسط پرتو درمانی
|
مرحله
|
تعداد بیماران
|
0/0
|
|
IA
|
29
|
100
|
|
IB
|
302
|
87/7
|
|
IIA
|
249
|
70/9
|
|
IIB
|
249
|
66/3
|
|
III
|
226
|
36/7
|
جدول 6.آدنوکار سینوم گردن رحم،میزان بقای 5 ساله عاری از بیماری.
|
مرحله
|
تعداد بیماران
|
0/0
|
|
IB
|
|
|
|
<3cm
|
91
|
88
|
|
3-4cm
|
65
|
65
|
|
4/1-5/9 cm
|
37
|
62
|
|
>6cm
|
22
|
45
|
|
iia
|
22
|
38
|
|
iib
|
38
|
28
|
|
iii
|
46
|
31
|
می دهد. بیشتر ضایعات به وسیله پرتوتابی کل لگن، که گره های لنفاوی لگن را به نحو موثری درمان کرده، اندازه ضایعه مرکزی را به شکل چشم گیری کوچک می کند، درمان شده اند. افزون بر این، ضایعه مرکزی توسط پرتوتابی محلی ناشی از مخروط های (ترانس واژینال) یا به وسیله کاشت بینابینی رادیوم،سزیوم یا ایریدیوم درون ضایعه نیز درمان شده است. برخی سازمان ها گزارش کرده اند که میزان بهبود کلی پرتودرمانی 50-40 درصد بوده است. تقریباً 80% ضایعات مرحله II به شکل موثری ریشه کن شده اند.
گرچه برخی سرطان های بزرگ سلول سنگفرشی فرج به نحو چشمگیری به پرتودرمانی پاسخ داده اند ولی پرتوهای یونیزان را به عنوان درمان انتخابی این ضایعه در نظر نمی گیرند. بافت های طبیعی واژن و گردن رحم می توانند دوزهای بالاتری از اشعه را تحمل کنند ولی فرج بیشترین حساسیت را به پرتوهای یونیزان نشان می دهد. برخی از زیست پرتوشناسان (radiobiologists) گمان می کنند که این ناحیه حاوی مقادیر زیاد و نامتناسبی از سرخرگهای انتهایی است که آسیب ناشی از پرتوتابی به فرج به ناچار با التهاب شدید فرج همراه است که تقریباً همواره نیازمند قطع درمان می باشد.
برداشت جراحی ضایعه فرج به وسیله
همچنان دزمان انتخابی است. ترکیب منطقی جراحی وسیع ناحیه ای و به دنبال آن پرتوتابی به گره های لنفاوی منطقه مبتلا، مزایایی دارد، بویژه در بیمارانی که قادر به تحمل برداشت جراحی گره های لنفاوی منطقه مبتلا نیستند.
کارسینوم آندومتر
کارسینوم آندومترشایع ترین ضایعه بدخیم رحم است. این ضایعه اغلب به عمق میومتر تهاجم پیدا می کند. معالجه ابتدایی به روش پرتو درمانی در گذشته انجام شده بود ولی قرار دادن منابع ایزوتوپ در نزدیکی (محل) بیماری به منظور آزاد سازی (دوز) بهینه ای از اشعه به تمامی ضایعه مرکزی معمولاً امکان پذیر نیست. به اثبات رسیده است که برداشتن رحم و ضمائم برای دستیابی به بهترین نتیجه ضروری است. در صورت تجزیه و تحلیل شمار زیادی از بیماران،آشکار می شود که افزودن هیسترکتومی به برنامه درمانی سرطان آندومتر حتی اگر داده ها را بر اساس مرگ ناشی از بیماری همزمان دیگر تصحیح کنیم، (میزان) بقاء را دست کم 20% بهبود می بخشد. برخلاف سرطان گردن رحم، درمان سرطان آندومتر تنها به وسیله پرتوتابی، عاقلانه نیست.
مرحله بندی ضایعات آندومتری در حال حاضر ماهیت جراحی داشته،اصولاً نیاز به انجام زودرس پرتودرمانی خارجی و درون حفره ای را پیش از جراحی، برطرف می کنند. مرحله بندی جراحی ابتدایی این امکان را فراهم می آورد تا پرتودرمانی تنها در موارد یافته های آسیب شناختی پرخطر، مانند: تهاجم عمقی به میومتر، درگیری آندوسرویکس یا متاستاز به ضمائم انجام شود.
برخی سازمان ها فرض را براین می گذارند که پرتوتابی به تنهایی،درمان کافی مرحله II سرطان آندومتر با گسترش به مجرای آندوسرویکس می باشد، ولی بر سر این فرض اختلاف نظر وجود دارد. بیشتر متخصصین بالینی ترجیح می دهند که مورد مشکوک به مرحله II را ابتدا با جراحی و سپس با پرتودرمانی متناسب با یافته های جراحی درمان نمایند. شاید برخی از بیماران مبتلا به تومور بزرگ گردن رحم به هیسترکتومی رادیکال نیاز داشته باشند.
پرتوتابی خارجی بعد از جراحی
بیشتر سازمان ها از کاربرد پرتودرمانی قبل از جراحی برای درمان کارسینوم آندومتر دست کشیده، دربیماران برگزیده، پرتوتابی خارجی و درون حفره ای (یعنی از طاق واژن) بعد از جراحی را جایگزین آن کرده اند. بیشتر داده های جمع آوری شده از مقالات دهه اخیر نشان می دهد که درگیری گردن یا (ایسم) رحم، تهاجم عمقی به میومتر و بافت
(آناپلاستیک)، احتمال عود لگنی بیماری را قویاً افزایش می دهد و ضرورتاً باید پرتوتابی کل لگن انجام شود. دوز مرسوم بین 4000 تا 5000 cGy در چند دوز منقسم می باشد که درطی 6-5 هفته تجویز می شود. دلیل واضح و بدون ابهامی مبنی بر بهبود (میزان ) بقاء (به وسیله این روش) وجود ندارد ولی به نظر می رسد مهار عود لگنی بیماری ، به ویژه عود در (کاف) (Caff) واژن کاملاً مستند باشد.
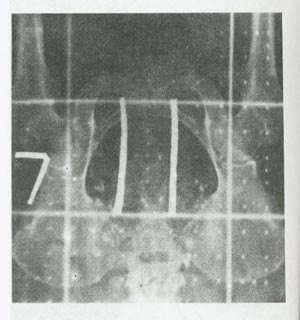
شکل 16:پرتو تابی کل لگن برای (درمان)سرطان گردن رحم که به بخش فوقانی واژن گسترش یافته است.لبه تحتانی میدان 18 سانتی متر در 18 سانتی متر کاملاً در زیر سمفیز عانه pubic symphysis قراردارد.نوارهای سربی (باریکه های سفید رنگ )به منظور محدود سازی زوایای میدان مربعی شکل به کار رفته ،حجم پرتو تابی را حدوداً 0/010 کاهش می دهد.
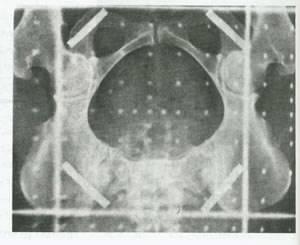
شکل 17:پرتو تابی پیرارحمی برای (درمان سرطان گردن رحم .یک قطعه سربی چهار سانتی متری بین باریکه های نوار سربی قرار گرفته ،خط وسط را محافظت می کند.ارتفاع میدان در مقایسه با شکل 16 به نحو چشمگیری کمتر است.تنها باید یک مانع در ارتفاع 10 سانتی متری خط وسط ایجاد کرد و بخش مرکزی فوقانی را نباید محافظت نمود زیرا نمایشگر (محل)گره های لنفاوی پوشش دهنده منطقه می باشد.
رادیوایزوتوپ های بعد از عمل
برخی از مولفین (وصاحب نظران) در بیماران مرحله I که شستشوهای صفاقی مثبت تنها شاهد موجود درباره بیماری خارج رحمی آنان است، کاربرد مرحله به مرحله و قطره ای درون صفاقی 32P کلوییدی را توصیه می کنند. این تکنیک در بخش مربوط به کارسینوم تخمدان بیشتر مورد بحث قرار خواهد گرفت.
کاربرد یک ایزوتوپ در طاق واژن پس از جراحی
بررسی های متعدد قویاً نشان داده اند که پرتودرمانی کمکی پس از جراحی برای درمان کارسینوم آندومتر به اندازه پرتودرمانی قبل از جراحی برای پیشگیری از عود ناحیه کاف واژن موثر است. برخی سازمان ها درصورت نبود علامتی دال بر درگیری گردن رحم یا وجود بافت (آناپلاستیک)، انجام
هیسترکتومی اولیه همراه با سالپنگواووفورکتومی (Salpingoophorectomy) دو طرفه را توصیه می کنند. اگر یک ناحیه مخفی از بیمار تمایز نیافته، درگیری پنهان گردن یا ایسم رحم، تهاجم عمقی به میومتر یا متاستاز به ضمائیم پیدا شد، پرتوتابی کل لگن مورد استفاده قرار می گیرد. اگر هیچ یک از شاخص های درگیری گره های لنفاوی یافت نشد، می توان از پرتودرمانی پس از جراحی اجتناب نمود یا ظرف یک هفته پس از هیسترکتومی، به کمک انواع اپلیکاتورهای واژینال cuff irradiation کرد. cuff irradiation ، که به وسیله مخروط های ترانس واژینال نیز انجام می شود،روش نسبتاً ساده ای بوده و معمولاً بدون (نیاز به) انجام بیحسی اضافی، صورت می پذیرد. در بیماران پرخطری که به دلیل کارسینوم آندومتر، متحمل هیسترکتومی شده اند، هیچ بررسی اتفاقی آینده نگری جهت تعیین ارزش واقعی cuff irradiation به تنهایی یا پس از پرتوتابی خارجی انجام نشده است. در واقع کاربرد cuff irradiation در این بیماران جنبه inutative داشته، بر پایه نتایج اثبات شده مشروح استوار نیست.
پرتودرمانی سرطان عود کننده
رشد و گسترش یک توده لگنی در بیماری که قبلاً کراسینوم آندومتر وی درمان شده است، ممکن است دال بر عود (بیماری) در دیواره جانبی لگن باشد. برای اثبات تشخیص و ترمیم محدوده گسترش بیماری باید در صورت امکان لاپاروتومی انجام شود. بیمارانی که دچار عود موضعی غیر قابل جراحی شده اند، نامزد کاشت دایمی هسته های ید 125(125I) یا کاشت منابع ایریدیوم قابل برداشت از راه پرینه می باشند.
چون پرتوتابی کل لگن تاکنون مورد استفاده قرار نگرفته است توجه باید به تعیین حدود عود به وسیله گیره های فلزی و تاباندن پرتوتابی خارجی به ناحیه مبتلا پس از جراحی معطوف شود. اگر عود در راس گنبد واژن باشد، درمان به اندازه ضایعه بستگی خواهد داشت. اگر قدرت تحمل بافت طبیعی تحت تاثیر پرتودرمانی قبلی قرار نگرفته باشد، باید پرتوتابی خارجی را مد نظر داشت. در مورد عود واژینال، معمولاً کشت بینابینی (منبع اشعه) یا استفاده از مخروط ترانس واژینال به پرتوتابی خارجی اضافه می شود. Dia Saia و همکاران در مورد عودهای مشابهی که پس از هسترکتومی قبلی رخ می دهند، درباره یک تکنیک کاشت باز در زمان لاپاروتومی گزارشی منتشر کردند (شکل 18). بدبختانه این عودهای لگنی اغلب در محدوده فیبروز و بافت بدون عروق ثانویه به پرتودرمانی قبل رخ داده و پاسخ عود لگنی به درمان سیستمیک با پروژستین یا شیمی درمانی از پاسخ عود در مناطق دوردست کمتر بوده، چندان رضایت بخش نیست.
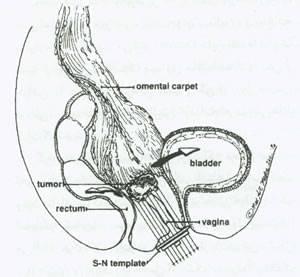
شکل 18:جاگذاری بافت امنتال (omental) در اطراف راس واژن که حاوی نئوپلاسم می باشد،پس از برگردان و تا زدن مثانه و رکتوم .
کارسینوم تخمدان
تقریباً 80% کارسینوم های اولیه تخمدان ازاپیتلیوم ژرمینال (زایا) منشاء می گیرند و این بافت جدید حساسیت محدودی به پرتوها دارد. به استثنای (دیس ژرمینوما)، بقیه کارسینوم های حجیم تیپیک تخمدان به وسیله پرتوتابی به آسانی درمان نمی شوند. گرچه آدنوکارسینوم ها حساسیت محدودی به پرتوها دارند ولی سایر تومورهای تخمدان، مانند: تراتوم بدخیم یا کارسینوم آمبریونال از نظر فقدان پاسخ به پرتودرمانی معرف می باشند. افزون بر حساسیت محدود بیشتر ضایعات تخمدانی به اشعه ها، این حقیقت که بیماری معمولاً در سراسر حفره صفاق پخش می شود، پرتودرمانی را با مانع روبرو می کند.
ریشه کنی همه تومورهایی که با چشم غیر مسلح دیده می شوند از راه جراحی، به نحو چشمگیری پاسخ به پرتودرمانی را تقویت می کند. Dembo نتایج بقاء را در یک دسته از بیماران که اندک بیماری باقیمانده آنها پس از جراحی، به وسیله پرتودرمانی شکم و لگن (و بدون شیمی درمانی) بهبود یافته، عالی گزارش کرد. انجام بررسی های اثبات کننده، ضروری است.
گرچه سرطان حجیم تخمدان درون لگن ممکن است به نحو رضایت بخشی به پرتوتابی لگنی استاندارد پاسخ دهد، وجود مناطق بزرگ باقیمانده بیماری در بخش فوقانی شکم نمایانگر یک معضل مهم پرتودرمانگرها (رادیوتراپیست ها) می باشد. هر گاه کل شکم در معرض خطرباشد، این مشکل چهره نشان می دهد. زیرا تحمل کل شکم به پرتوتابی اندک بوده، دوزی که می توان با اطمینان به شکم تاباند، خیلی پایین تر از دوز نابود کننده توموراست،شکم دوز بیشتر از 2500cGy را تحمل نمی کند. fletcher پیشنهاد کرد با تکنیک باریکه متحرک به حفره صفاق اشعه داده شود، که در این تکنیک قطعات کوچکی از شکم به نحو منظمی در معرض پرتوهایی با شدت بالا قرار می گیرند. این تکنیک از نظر تئوری عوارض و ناخوشی را در سطح قابل قبولی نگه داشته و از نظر زیست پرتوشناسی امکان تاباندن دوزهای موثر بزرگ تری را فراهم می آورد. بسیاری از سازمان ها نتوانسته اند این تکنیک را با موفقیت در پیش گیرند و ارزش این روش همچنان نامعلوم است (شکل 19).
فعلاً تکنیک درمانی سرطان تخمدان مرحله I وII شامل تزریق اندک 32P کلوییدی به درون حفره صفاق پس از جراحی مورد علاقه است. اگر همه بیماری قابل مشاهده توسط چشم غیر مسلح، پس از هیسترکتومی و سالپنگواووفورکتومی دو طرفه برداشته شود و تنها کشت های میکروسکوپی از بقایای سلولی برای درمان پس از جراحی باقی بماند، فسفر 32(32P) پرتوهای بتا منتشر می کند که تنها تا عمق 4-1 میلی متر نفوذ می کند،مواد کلوییدی به سطوح صفاق چسبیده یا توسط آنها فاگوسیته شده،می توانند پرتوهای یونیزان خود را در همان محل به سلولهای بدخیم روان کنند. هیچ بررسی اتفاقی آینده نگری منتشر نشده است که نشانگر برتری این روش به شیمی درمانی باشد.
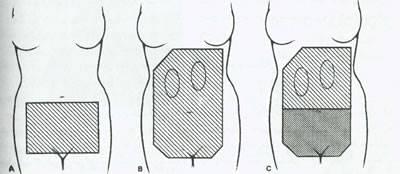
شکل 19:سه میدان پرتو تابی با کاربرد رایج.(A)میدان لگنی که برای پرتو تابی کل لگن استفاده می شود.(B)میدان کل شکم که برای مراحل اولیه سرطان تخمدان و سرطان اندومتر با نتایج مثبت سیتولوژی استفاده می شود.(C)میدان کل لگن همراه یک محافظ لگن که در سرطان تخمدان برای درمان پس از جراحی و برداشت عمده بیماری واضح و قابل رویت به کار می رود.
تدابیر درمانی اصلاح شده
دربرخی بیماریهای بدخیم، با استفاده از ترکیب هیپرترمی و پرتودرمانی، امکان دو برابر کردن میزان پاسخ درمانی کامل وجود دارد. گرچه در درمان بیشتر انواع سرطان های بالینی ارزش عملی ندارد(ولی) دلایلی وجود دارد،ازجمله: افزایش روز افزون درک ما از مکانیسم های
سیتوتوکسیک دماهای بالا، قدرت تکنیکی روز افزون و دقت روبه رشد ابزارها که بافت را گرم و میزان گرمایش را دقیق بررسی می کند. و رواج مفهوم درمان چند ابزاری _که در آن هیپرترمی ،پرتو درمانی و شیمی درمانی به شکل رژیم های دو ابزاری یا سه ابزاری با هم ترکیب می شوند) که ما را در قرن آینده به تبدیل یا این ابزار کمکی درمانی به یک روش ارزشمند، امیدوار می کند.
بعید است که هیپرترمی به تنهایی قادر به ایجاد پسرفت عمده تومور با قدرت پیشگویی کننده کافی باشد که بتواند آنرا به یک ابزار درمانی کمک عملی تبدیل کند،ولی همانگونه که توسط چندین الگوی پیش بالینی و به کمک سرطانهای سطحی که می توان آنها را به اندازه کافی گرما داد، اثبات شده است. هیپرترمی در شرایط بهینه می تواند تاثیر پرتودرمانی را تشدید نماید. بین هیپرترمی و انواعی از داروها که به DNA سلولی آسیب می رسانند یا با سوخت و ساز انرژی سلول تداخل می کنند، یک واکنش متقابل قویاً مثبت وجود دارد. مشاهدات اولیه درباره واکنش متقابل سه ابزار درمانی؛ پرتوتابی، هیپرترمی و شیمی درمانی شدیداً دلگرم کننده بوده است.
پرتودرمانی جزء لازم درمان شفابخش سرطان است ولی قدرت تحمل بافت های طبیعی که پرتوها از آنها می گذرند و مقاومتی که توده سلول های تومور به تدریج دربرابر اشعه کسب می کنند. قابلیت شفای برخی تومورها، بویژه تومورهایی را که مراحل بالینی بالاتری دارند، محدود می سازند. ممکن است پژوهشهای زیست پرتوشناسی و فیزیک پرتوها روشهایی فراهم کند که ضمن کاهش عوارض و ناخوشی، میزان شفای (بیماری) را ازدیاد بخشد. درمان پویای (dynamic) کامپیوتری، داروهای محافظ در برابر پرتوها، اکسیژن پرفشار، پرتوتابی ذره ای و داروهای حساس کننده سلول به هیپوکسی در حال ارزیابی بالینی بوده، برخی از نتایج مقدماتی آنها دلگرم کننده است.
از میان تدابیر مختلف بهبود نتایج بالینی پرتودرمانی مرسوم سرطان، کاربرد پرتودرمانی ذره ای باردار یا غیرباردار جذابیت ویژه ای دارد.اینگونه پرتوتابی ها، بسته به تابش ذره ای مورد درخواست،مزیت زیست شناختی، مزیت توزیع دوز یا هر دو را با هم دارا می باشند.نوترون هایی سریع که ذرات بدون باری هستند، خواص زیست پرتوشناسی بهتری نسبت به پرتوهای ایکس یا اشعه گاما دارند.
درمیان ذرات باردار، پروتون ها و یون های هلیوم ویژگی های توزیع دوز بهتری را به معرض نمایش می گذارند، پیون (Pion) و یون های سنگین مانند: کربن 12، نئون 20، سیلیکون 28 و آرگون 40 مزایای توزیع دوز و مزایای زیست شناختی بالقوه ای دارند. رده بندی تئوری پرتوهای ذره ای نشان می دهد که یون های سنگین و پیون ها ممکن است برای درمان بهتر باشند.گرچه احتمالاً بیشتر نظریه درست است، ولی رابطه نتایج بالینی (با نظریه) ضعیف بودن و چندان قابل اثبات نمی باشد. بیشتر پژوهش های بالینی درباره پرتوتابی ذره ای در ایالات متحده بر نوترون ها، پروتون ها و یون های هلیوم متمرکز بوده است. انتخاب ها عمدتاً براساس ملاحظات مادی و قیمت ها تعیین می شوند. یون های سنگین و پیون ها از نظر تئوری بهتر از نوترون ها، پروتون ها و یون های هلیوم هستند ولی تولید آنها بسیار گران تر تمام می شود. به رغم سختی تولید و سایر مشکلات، پرتودرمانی ذره ای در بررسی های محدود و کوچک اثر چشمگیری بر چند سرطان داشته است، ولی جهت اثبات این موضوع به بررسی های اضافی نیاز می باشد.
منبع:مامایی و بیماریهای زنان دنفورث،جلد دوم.
/ج