بیماری های بدخیم تخمدان
بیماریهای بدخیم تخمدان در سنین 40-20سال اغلب یک تومور سلول استروما - طناب جنسی هستند. تومورهای بدخیم اپی تلیال نیز رخ می دهند ولی نادر هستند. در این گروه سنی ، وراثت ژنتیکی می تواند یک عامل افزایش دهنده ریسک کارسینوم اپی تلیال تخمدان باشد. درمان این بیماران (که در بخش بعدی مورد بحث قرار خواهند گرفت) یک مبحث جالب برای متخصصین زنان است.
تومورهای طناب جنسی - استروما: تومورهای سلول سرتولی-لیدیگ
تومورهای سلول سرتولی- لیدیگ به نام تومور سلول سرتولی- استروما نیز نامیده می شوند و می توانند به زیرگروههای متعددی تقسیم شوند (جدول 5). به نظر می رسد مرحله بیماری و میزان تمایز تومور فاکتورهای مهم پیش گویی کننده پیش آگهی باشند. علی رغم نام این تومورها، تولید هورمون همیشه همراه با آنان دیده نمی شود. تومورهایی که هورمون تولید می کنند، می توانند باعث ایجاد فتوتیپ زنانه یا مردانه شوند، ولی تعداد کمی از تومورها عملاً هورمون استروژن یا پروژسترون تولید می کنند.

شکل 42:کاشته مهاجم یک تومور حد واسط سروز .در اینجا تومور پر سلول تر است.کاشته های مهاجم به زیر پریتوان گسترش یافته و همراه بادسموپلازی واکنشی هستند.
تومورهای سلول سرتولی
این تومورها بسیار نادرهستند. محدوده سنی بیماران از 7 تا 79 سال متغیر است(سن متوسط 33سال) و معمولاًبا یک توده لگنی یا شکمی تظاهر می یابند. اگر این توده فعال باشد، بیماران ممکن است با شکایات ناشی از اثرات استروژنیک مانند هایپرپلازی اندومتر و یا بلوغ کاذب زودرس همجنس مراجعه نمایند. همچنین ممکن است اثرات آندروژنی یا پروژسترونی ظاهر شود. اکثراً تومورها در مرحله I بیماری واقع شده و یک طرفه و با محدوده مشخص هستند و حدود 9 سانتی متر قطر دارند. در برش بافتی جامد، زرد - قهوه ای و حفره دار هستند. در بررسی میکروسکوپی توبول های چسبیده به هم توخالی و یا توبولهای جامدی که با سلول های سرتولی مفروش شده اند و گاهی حاوی لیپید
جدول 5:طبقه بندی سازمان بهداشت جهانی از تومورهای طناب جنسی -استروما
|
سلول های استرومای گرانولوزا
سلول گرانولوزا
تکوما -فیبروما
آندروبلاستوم :تومورهای سلول سرتولی -لیدیگ
1-تومور با تمایز خوب
تومور سلول سرتولی
تومور سلول سرتولی -لیدیگ
تومور سلول لیدیگ-تومور سلول نافی
2-توموربا تمایز حدواسط
3-تومور با تمایز اندک (سارکوماتوز )
4-تومور با اجزا هترولوگ
-تومور با اجزاء هترولوگ
-ژیناندروبلاستوم
-طبقه بندی نشده
|
سیتوپلاسمی زیادی هستند به چشم می خورند. در مقالات به ارتباط بین تومورهای سلول سرتولی و سندرم پوتز - جگر اشاره شده است. اکثر تومورهای سلول سرتولی خوش خیم و یا نئوپلاسم های بدخیم در مراحل اولیه هستند که با درمان جراحی بهبود می یابند. جراحی محافظه کارانه با سالپنگواوفورکتومی یک طرفه در بسیاری از بیماران که جوان بوده و خواهان حفظ فعالیت تخمدان هستند، درمان انتخابی است. تنها به ندرت ممکن است این تومورها کم تمایز و مهاجم باشند. تجربه در مورد سودمندی شیمی درمانی در این تومورها به علت نادر بودن آنها محدود است.
تومورهای سلول سرتولی- لیدیگ
تومورهای سلول سرتولی لیدیگ مسئول کمتر از 0/5 0/0 از تمام تومورهای تخمدان هستند. بیشتر در زنان جوان دیده شده و سن متوسط بروز آن 25 سال است. کمتر از 0/010 این تومورها در زنان بالاتر از 50 سال رخ می دهند و کمتر از 0/05 دختران پیش از سن بلوغ وجود دارند. تومور سلول سرتولی- لیدیگ اغلب همراه با تولید آندروژن است، ولی تنها حدود 0/50 از بیماران علائم ویریلیزاسیون را پیدا کنند. این ممکن است به علت کمبود تولید هورمون و یا تولید ناکافی آن باشد. به طور تیپیک بیماران از الیگومنوره شاکی هستند که به دنبال آن ممکن است آمنوره، آتروفی پستان ها، اکنه ، هیرسوتیسم، طاسی تمپورال، بم شدن صدا و بزرگی کلیتوریس رخ دهد. دو علامت آخر ممکن است بعد از برداشتن تومور برطرف نشوند. بیمارانی که علائم اندوکرین ندارند ممکن است از درد یا تورم شکم شاکی باشند. به ندرت ممکن است، علائم تولید استروژن به علت وجود سلول های سرتولی در تومور و یا تبدیل محیطی آندروژن ها به استروژن به صورتی منوراژی و منومتروراژی در بیمار ظاهر شود. تومورهای سلول سرتولی- لیدیگ باید از سایر تومورهای ویریلیزان مانند تومورهای آدرنال که اغلب همراه با افزایش سطح 17 کتواستروئیدها هستند، افتراق داده شوند. سطح ادراری 17 کتواستروئید ها در تومور سرتولی- لیدیگ طبیعی و یا کمی افزایش یافته است. همچنین ممکن است سطح AFP سرم افزایش یابد و به عنوان یک تومور مارکر اندازه گیری آن مفید واقع شود.
نمای ظاهری تومور سلول سرتولی- لیدیگ بسیار متغیر است. به طور کلی قطر متوسطی حدود 12-15 سانتی متر دارد وسطح برش داده شده معمولاً طلایی یا زرد است و ممکن است کیستیک باشد (شکل 43). در تومورهایی که تمایز ضعیف دارند خونریزی و نکروز به طور شایع دیده می شود در معاینه میکروسکوپی، تومور از مخلوطی از سلول های استرومای گنادی نامتمایز سرتولی و لیدیگ تشکیل شده که ممکن است اجزاء هترولوگ داشته باشند یا نداشته باشند که درجات و نسبت تمایز آنها متفاوت است. در ضایعاتی که به خوبی تمایز یافته اند،سلول های سرتولی تشکیل توبول می دهند و سلول های لیدیگ در استرومای بینابینی دیده می شوند (شکل 44). سلول های سرتولی از لحاظ سیتولوژی حاوی اشکال میتوتیک نادری هستند. سلول های لیدیگ ممکن است حاوی پیگمان های لیپوکروم فراوان یا کریستالوئیدهای Reinke باشند. تومورهای حد واسط و کم تمایز یافته با اجزای نابالغ تر سرتولی و لیدیگ همراه هستند.
غضروف، اپی تلیوم موسینی، عضلات اسکلتی سایر اجزای هترولوگ در 20 الی0/025 این تومورها دیده می شود که اکثرا از تمایز حد واسطی برخوردارند. در کسانی که اجزای هترولوگ در نئوپلاسم های کم تمایز یافته دیده می شوند، تومورها از لحاظ بالینی بدخیم هستند، تومورهای سلول سرتولی -لیدیگ با یک الگوی شبکه ای ممکن است همراه با پرزهای هیالنینیزه شده واضح و پاپی هایی که توسط سلول های اپی تلیال مطبق پوشیده شده تظاهر کنند.
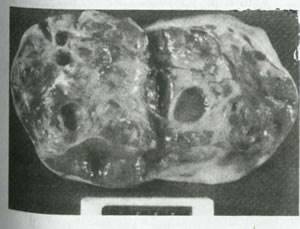
شکل 43:تومور سلول سرتولی -لیدیگ .سطح برش داده شده،زرد -قهوه ای نرم و تا حدی کیستیک است.
درمان تومورهای سلول سرتولی - لیدیگ اغلب بستگی به سن بیمار و مرحله تومورو درجه تمایز دارد. همچنین حضور یا عدم حضور اجزای هترولوگ در آن مهم است. مهمترین
عامل در پیش آگهی، مرحله تومور است. در خانم های جوانی که مبتلا به مرحله I از تومور خوب تمایز یافته و خواهان حفظ قدرت باروری خود هستند، یک ساپنگواوفورکتومی یک طرفه و مرحله بندی دقیق درمان کافی است(به جدول 3 مراجعه شود). هر چند جراحی تهاجمی تر کاهنده سلول، شامل یک هیسترکتومی و سالپنگواوفورکتومی دو طرفه، برداشتن تومور و انجام مرحله بندی ممکن است در بیماران یائسه یا آنان که بیماری پیشرفته تری دارند لازم باشد.
درمان کمکی در بیمارانی که در مرحله I، با تمایز ضعیف هستند و یا اجزای هترولوگ دارند و همچنین در کسانی که بیماری متاستاتیک دارند توصیه می شود. ولی از آنجا که تعداد موارد بیماری محدود هستند، هنوز یک درمان کمکی استاندارد برای این بیماران پیشنهاد نشده است.
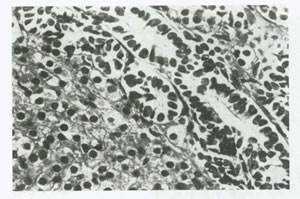
شکل 44:تومور سلول سرتولی-لیدیگ .این تومور خوب تمایز یافته از توبول های تو خالی که توسط سلول های سرتولی مفروش شده اند و صفحات سلول لیدیگ در مجاورت ان تشکیل شده است.
بیشتر اطلاعات در دسترس از مطالعات کوچک و گزارشهای محدود به دست آمده است. درمان تومورهای پیشرفته محدود به دست آمده است. درمان تومورهای پیشرفته سلولهای استروما- طناب جنسی، برخلاف تومورهای سلول ژرم با موفقیت زیادی همراه نیست. بر خلاف تومورهای سلول ژرم با موفقیت زیادی همراه نیست. بهترین نتایج از درمان داروهایی که پایه پلاتینیوم دارند حاصل شده و طول عمر کلی حدوداً0/050 است. این داروها شامل VBP, PAC و BEP هستند. همانند شیمی درمانی، رادیوتراپی نیز در موارد محدودی موفقیت آمیز بوده است.
تومورهای سلول استروئید که طبقه بندی نشده اند.
این تومورها در گذشته سلول های لیپدی یا تومورهای لیپوئید نامیده می شد. اینها تومورهایی هستند که تماماً از سلول های شبیه به سلول های تولید کننده استروئید (مثل : سلول های لوتئین، سلول های لیدیگ و سلول های کورتکس آدرنال) تشکیل شده اند، با این تفاوت که مشخصات ویژه ای همچون منشاء گرفتن از ناف تخمدان یا کریستالوئیدهای Reinke در اینها دیده نمی شوند. تومورهای سلول استروئید که هیچ طبقه بندی خاصی ندارند (NOS)، حدود 1% از کل تومورهای تخمدان را تشکیل می دهند و سن متوسط بروز آنها 43 تا 60 سال است. تغیرات آندروژنیک در 75 تا 90 درصد از بیماران رخ می دهد و ممکن است در طی سالیان طولانی ایجاد شوند. تغییرات استروژنی و پروژستینی ندرتاً دیده می شود. هر چند تظاهرات استروژنی ممکن است به علت تولید استروژن توسط تومور باشد، آروماتیزاسیون آندروژن ها در بافت های محیطی و تبدیل آنها به استروژن ممکن است غالب تر باشد. همچنین بیماران می توانند علائم سندرم کوشینگ را به علت افزایش سطوح سرمی کورتیزول نشان دهند. تشخیص معمولاً بر پایه تظاهرات کلینیکی ویزیلیزاسیون و یا ندرتاً بلوغ زودرس کاذب همجنس است. برداشتن تومور منجر به بهبود سریع اکثر اثرات هورمونی، به استثنای بم شدن صدا و کلیتورومگالی می شود.
در نمای ظاهری، تومورهای NOS سلول استروئید، جامد، با محدوده مشخص و زرد رنگ یا نارنجی - طلایی هستند و 8 تا 5 سانتی مر طول دارند. ندرتاً علائم نکروز، خونریزی و دژنرسانس کیستیک نیز ممکن است دیده شود. در سطح برش داده شده، تومورنرم و چند حفره ای است. از لحاظ میکروسکوپی، سلول های تومور ممکن است شبیه به سلول های لیدیگ یا نافی باشند.(شکل 45).
در سایر موارد، سلول ها ممکن است مانند سلول های آدنوکورتیکال حاوی سیتوپلاسم فراوان روش باشند. این سلول ها چند وجهی یا گرد بوده و از سلول های لیدیگ بزرگتر هستند. هسته ها مرکزی بوده و سیتوپلاسم غنی از چربی است. شباهت زیاد بسیاری از این تومورها به تومورهای آدرنوکورتیکال باعث این فرض شده که شاید آنها از بقایای آدرنوکورتیکال منشاء می گیرند. ارتباط بین آنها و علائم سندرم کوشینگ منشا می گیرند. ارتباط بین آنها و علائم سندرم کوشینگ نیز به این فرضیه قوت می بخشد و در برخی از آزمایشات وجود این بقایا در لیگامان پهن و ناف تخمدان به اثبات رسیده است. از طرف دیگر، با توجه به این حقیقت که تومورهای سلول استروئید NOS اغلب محدود به تخمدان هستند ممکن است تولید هورمون ها آدرنورکورتیکال در آنها نیز از منشا تخمدانی باشد و نه ازیک تومور اکتوپیک آدرنال، تومورهای سلول استروئید NOS به ندرت بدخیم هستندو حدود 10 الی 15 درصد آنان عود کرده تا متاستاز می دهند.
یک سالپنگواوفورکتومی یک طرفه جهت مراحلI aبیماری در خانمهای جوان و در سنین تولید مثل کافی است. انجام هیسترکتومی شکمی و سالپنگواوفورکتومی دو طرفه با مرحله بندی و برداشتن تمام کاشته های خارج تخمدانی در بیماران مبتلا به بیماری پیشرفته و یا سنین بالاتر پیشنهاد می شود.
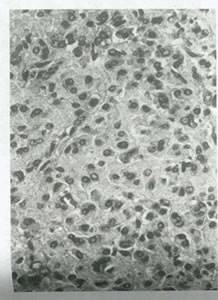
شکل 45:تومور سلول استروئید طبقه بندی نشده .اگر کریستالوئیدهای Reinke در این تومورها وجود داشت ،تومور به عنوان سک تومور به عنوان یک تومور سلول لیدیگ یا سلول نافی طبیه بندی می شد که بسته به محل تومور بود.نمای گرانولر سیتوپلاسم در این سلول های توموری گرد تا چند وجهی مشخص کننده محتوای لیپیدی آنها است.
سنین بالای 40 سال
شایعترین بدخیمی تخمدان در زنان بالای 40 سال کارسینوم اپی تلیال تخمدان است که میزان بروز آن بعد از 55 سالگی افزایش می یابد. بسیاری از بیماران با علائم بیماری متاستاتیک مراجعه می کنند. بقیه ممکن است با یک توده تخمدانی مراجعه کنند که تشخیص افتراقی های متعددی جهت آن مطرح است ( شکل 46). ارزیابی دقیق بیماران قبل از عمل باید جهت بدست آوردن اطلاعات کافی برای پیشگویی دقیق اینکه توده خوش خیم یا بدخیم است انجام شود. سپس می توان مناسب ترین تیم جراحی را انتخاب کرد.
کارسینوم لوله فالوپ
کارسینوم اپی تلیال اولیه لوله های فالوپ
بیش از 96% از تمام تومورهای لوله فالوپ، تومورهای اپی تلیال تهاجمی هستند ولی با این وجود کارسینوم لوله فالوپ هنوز یکی از نادرترین بدخیمی های زنان است و سالانه به طور متوسط در 3/6 مورد از هریک میلیون زن رخ می دهد. جوانترین سن گزارش شده 14 سال است و میزان بروز آن به سرعت افزایش یافته و در 60 الی 64 سال است و میزان بروز آن به سرعت افزایش یافته و در 60الی 64 سال به اوج خود می رسد. اطلاعات اپیدمیولوژیک اخیر، پیشنهاد می کند که سن بالا و نولی پاریتی فاکتورهایی مستعد کننده جهت کارسینوم لوله فالوپ هستند. لازم به یادآوری است که این فاکتورها، جهت کارسینوم اندومتر و تخمدان نیز فاکتور مساعد کننده به شمار می روند. درگذشته، گزارشاتی مبنی بر بروز سالپنژیت های مکرر در بیماران مبتلا به کارسینوم لوله فالوپ وجود داشت و اشاره شده که عفونت لوله فالوپ ممکن است رل مهمی در پاتوژنز بیماری داشته باشد. با این وجود شیوع بالای عفونت های لگنی و نادر بودن کارسینوم فالوپ این ارتباط را زیر سوال می برد.
شکل 46:تشخیص افتراقی بیماران بالاتر از 40 سال
|
تشخیص افتراقی
A.بیماریهای خوش خیم لوله فالوپ
B.کانسرهای لوله فالوپ
1.تومورهای اپی تلیال
2.سارکوم ها
3.کوریوکارسینوم
4.تومورهای متاستاتیک
C.بیماریهای خوش خیم تخمدان
1.کیست های عملکردی
2.اندومتریوم (به فصل 42 در مورد اندومتریوز مراجعه شود .)
3.عوامل عفونی :آبسه های توبواوارین (به فصل 37 در مورد PIDمراجعه شود ).
4.نئوپلاسم های خوش خیم اپی تلیال
a.سیست آدنوم سروز
b.سیست آدنوم موسینوس
c.سیست آدنوم آدنوفیبروم
d.تومور برنر
5.تومورهای استروما -طناب جنسی
a.تکوما
b.فیبروم
c.تومورهای سلول نافی
D.تومورهایی با پتانسیل بدخیمی کم
E.تومورهای اپی تلیال بدخیم
1.تومورهای سروز
2.تومورهای موسینوس
|
|
|
3.تومورهای اندومتروئید
4.تومورهای سلول روشن
5.کارسینوم غیر متمایز
6.توموربرنر
7.تومورهای مزانشیمال و مختلط مولرین
F.تومورهای استروما،طناب جنسی
1.تومورهای سلول گرانولوزا
2.آندروبلاستوم ،تومورهای سلول سرتولی -استروما
a.تومورهای سلول سرتولی -لیدیگ
b.تومورهای سلول استروئید
|
علائم بیماران شامل درد لگن، توده لگنی و ترشحات سروزی خونی واژینال است. هیدروپس پروفلونس لوله ها (Hydrops tudae prorluens) با دردهای کولیکی پایین شکم که متعاقباً ترشح شدید سروزی و آبکی زرد رنگ از واژن بهبود می یابد تعریف می شود. هرچند این یافته در نزد همه بیماران مبتلا دیده نمی شود ولی علامت کلاسیک کارسینوم لوله فالوپ است. سایر علائم شامل خونریزی غیر طبیعی از واژن، تورم شکم، احساس فوریت در دفع ادرار، تغییر در حرکات روده، درد پشت و شکم حاد به علت پیچ خوردگی ویا خونریزی داخل شکمی است. شایعترین یافته فیزیکی یک توده لنگی یا شکمی است. شایعترین یافته فیزیکی یک توده لگنی یا شکمی است که اغلب این توده تخمدانی است که در زمان عمل جراحی تشخیص دقیق آن میسر می شود ندرتاً، ممکن است تشخیص بیماری از طریق یک پاپ اسمیر که حاوی سلول های غددی غیر عادی همراه با یافته های منفی سرویکس یا اندومتر است داده شود. سطح CA125 سرم اغلب در موارد پیشرفته بیماری بالاست که در 80% مبتلایان به کارسینوم تخمدان، بسیاری از مبتلایان با کانسر لوله فالوپ را ممکن است بتوان در مراحل اولیه بیماری شناسایی نمود. در یک بازنگری از مقالات متعدد، 2/3 بیماران مبتلا به کارسینوم لوله فالوپ در مرحله I(0/033) ویا مرحله II (0/034) بیماری شناسایی شدند. در جدول 6، یک طبقه بندی کانسر لوله فالوپ توسط FIGO در سال 1991 ارائه شده دیده می شود.
کارسینوم لوله فالوپ، معمولاً توسط تورم ها به علت رشد داخل مجرایی آن مشخص می شود. تنها پس از باز کردن بافت لوله است که علت عفونی را می توان کنار گذاشت و در برش بافتی، لوله متورم بوده و با یک تومور پاپیلری یا جامد پر شده است (شکل 47). ممکن است مناطق از نکروز و خونریزی نیز دیده شود. تومور در 10 تا 26 درصد از بیماران دو طرفه است ولی علت دو طرفه بودن خوب مشخص نشده، چون بعضی معتقدند نشاندهنده یک متاستاز است و بعضی معتقد به علت چند کانونی بودن تومور هستند. قسمت عمده تومورهای لوله فالوپ آدنوکارسینوم نوع سروز است که از لحاظ بافت شناسی مشابه با کار سینوم سروز تخمدان می باشد. بقیه انواع گزارش شده که بسیار نادر می باشند شامل: موسینوس، اندومتروئید، سلول روشن و اسکواموس هستند. آدنوکارسینوم سروز تمایز یافته از پاپی های ظریف و شاخه شاخه تشکیل +1106
شده است. در حالی که نوع کم تمایز آن حاوی صفحات توپر سلولی با نواحی نکرز است(شکل 48).
یافته های تشخیصی متعددی تاکنون جهت افتراق بدخیمی لوله فالوپ از کانسر تخمدان و سایر تومورهای اولیه مطرح شده است. از لحاظ میکروسکوپی، تومور از آندوسالپنکس منشا می گیرد و الگوی بافتی شبیه به اپی تلیوم موکوس لوله ها دارد. تغییر از فرم خوش خیم به اپی تلیوم بدخیم دیده می شود. تخمدان و اندومتر ممکن است طبیعی بوده و یا حاوی توموری کوچکتر از لوله ها باشند. همانند کارسینوم اپی تلیال تخمدان، تومور اپی تلیال لوله فالوپ نیز می تواند از طریق گسترش مستقیم، کانال های لنفاتیک و یا راه خونی در بدن پخش شود. متاستازهای دور دست شایع نیستند.
درمان تومورهای اولیه اپی تلیال لوله فالوپ بر پایه درمان استاندارد کارسینوم تخمدان است، چرا که به علت نادر بودن آن مطالعات گسترده زیادی در این مورد در دسترس نیست. همانند کانسرهای تخمدان، جراحی همراه با یک هیسترکتومی کامل و سالپنگواوفورکتومی دو طرفه، برداشتن بقایای تومور و یک مرحله بندی دقیق درمان اصلی بیماری به شمار می رود. براساس مطالعات بیماری، درمان اصلی بیماری به شمار می رود. براساس مطالعات بیماری، درمان با ترکیبات پلاتی نیوم متعاقب جراحی توصیه شد و بقای 5 ساله ای بالاتر از 50% را در مراحل پیشرفته بیماری (مرحله IIIو IV) به همراه دارد. به علت نادر بودن کانسر لوله فالوپ، (Taxol) paclitaxel) هنوز به طور گسترده در درمان آن مورد استفاده قرار نگرفته ولی براساس آمار به دست آمده از مبتلایان به کانسر تخمدان می تواند در اینجا نیز عامل درمانی فعالی به شمار رود. از مدروکسی پروژسترون استات و مژسترول استات (Megace) نیز دردرمان کارسینوم لوله فالوپ استفاده شده است ولی مطالعات اولیه سودمندی این ترکیبات پروژستینی را به اثبات نرسانده است. سایر عوامل، همچون تاموکسی فن سیترات (Nolvadex) ممکن است نقشی در درمان این تومور داشته باشد.
همانند تومور تخمدان، پیش آگهی بستگی به میزان گسترش بیماری و مقدار باقیمانده تومور پس از جراحی دارد. جراحی نگاه دوم ممکن است در تعیین کارایی درمان و میزان باقی مانده بیماری موثر باشد ولی مشابه تومور تخمدان نباید آن را در حال حاضر به عنوان درمان استاندارد در نظر گرفت
جدول6:مرحله بندی FIGoجهت کانسر لوله فالوپ
|
مرحله O:کارسینوم درجا (in Situیا محدود به مخاط لوله )
مرحله :رشد تومور محدود به لوله های فالوپ است .
Ia:رشد محدود به یک لوله است و به زیر مخاط و یا لایه عضلانی هم نفوذ کرده ولی به سطح سروز نرسیده ،آسیت وجود ندارد .
Ib:رشد محدود به هر 2لوله است و به داخل زیر مخاط و یا لایه عضلانی هم نفوذ کرده ولی به سطح سروز نرسیده ،آسیت وجود ندارد .
Ic:تومور مرحله Ia یاIbبا گسترش به داخل سروز لوله یا در حضور آسیت حاوی سلول های بدخیم و یا شستشوی مثبت مایع پریتوان .
مرحلهII:رشد تومور یک یا دو لوله را درگیر کرده است و گسترش به داخل لگن نیز دارد .
IIa:گسترش و یا متاستاز به رحم و یا تخمدانها .
IIb:گسترش به سایر بافت های لگن
Ibهمراه با آسیت حاوی سلول های بدخیم یا شستشوی مثبت مایع پریتوان IIc:تومور مرحله IIaیاI
.
مرحلهIII:تومور یک یا دو لوله فالوپ را درگیر کرده و کاشته های پریتوان خارج لگن نیز داریم و یا غدد لنفاوی رتروپریتوان با اینگوینال درگیر هستند .متاستاز سطحی کبد معادل مرحله IIIاست.به نظر می رسد تومور محدود به لگن حقیقی است ولی از لحاظ بافت شناسی گسترش ثابت شده به روده باریک یا امنتوم دارد .
IIIa:تومور از لحاظ ظاهری محدود به لگن حقیقی است ولی لنف نودها منفی بوده و از لحاظ بافت شناسی انتشار میکروسکوپی سطح پریتوان شکمی وجود دارد .
IIIb:تومور یک یا هر دو لوله را درگیر کرده و کاشته های بافت شناسی مثبت سطح پریتوان شکمی کمتر یا مساوی 2cmوجود دارد .لنف نودها منفی هستند .
IIIc:کاشته های پریتوان بزرگتر از 2 سانتی متر هستند و یا لنف نودهای رتروپریتوان یا اینگوینال درگیرند .
مرحله Iv:رشد تومور یک یا دو لوله را درگیر کرده و متاستاز دور
دست نیز داده است.اگر افیوژن پلور موجود باشد.باید
سیتولوژی آن مثبت باشد تا بیمار در مرحله IVواقع شود .متاستاز به پارانشیم کبد معادل با مرحله IV بیماری است.
|
سارکوم لوله فالوپ
سارکوم به نوع خالص یا مختلط تقسیم بندی می شود. بسیار نادر است و تاکنون کمتر از 50 مورد از آن گزارش شده است و معمولاً در خانمهای سنین بعد از یائسگی دیده می شود. درد شکم و ترشح آبکی یا خونی با علائم انتشار پریتوان یافته های شایع هستند. با مشخص نمودن بافت طبیعی باقیمانده تخمدان، منشا تخمدانی آن را باید رد کرد. امید به زندگی این بیماران معمولاً تنها چند ماه است. همانطور که درموارد گزارش شده، اشاره شده شیمی درمانی و رادیاسیون موثر نیستند.
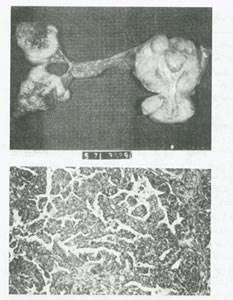
شکل 47:کارسینوم لوله فالوپ.مجرای لوله فالوپ و دیواره های آن توسط تومور جایگزین شده است.
- شکل 48:کارسینوم لوله فالوپ .کارسینوم سروز لوله فالوپ ظاهر میکروسکوپی مشابه کارسینوم اولیه تخمدان دارد.در این مثال سلول ها به صورت پا پی های ظریف و آشیانه های مجزا طبقه بندی شده اند.
کوریوکارسینوم لوله فالوپ
در مقایسه با سارکوم لوله فالوپ، کوریوکارسینوم آن حتی نادرتر است. ممکن است به دنبال بیماری تروفوبلاستیک بارداری همراه با یک حاملگی به دنبال بیماری تروفوبلاستیک بارداری همراه با یک حاملگی خارج رحمی یا از بقایای یک تومور ژرم سل خارج تخمدانی منشاء گیرد. هیستولوژی آن شبیه به کوریوکارسینوم رحم است. درمان نیز مشابه درمان کوریوکارسینوم می باشد. در حال حاضر به علت محدودیت تعداد موارد گزارش شده، هیچ توصیه درمانی استانداردی جهت این بیماری در دسترس نیست.
بیماری متاستاتیک
بیماری متاستاتیک لوله فالوپ از تومورهای اولیه آن شایعتر است و معمولاً از یک تومور اولیه تخمدان اندومتر و ندرتاً تومور اولیه پستان، دستگاه گوارش و یا سرویکس منشاء می گیرد.
درگیری لنفاتیک و اپی تلیوم سالم یک تومور متاستاتیک را از تومور اولیه لوله فالوپ افتراق می دهد. کرایتریایی تشخیصی جهت افتراق بین تومورهای اولیه لوله فالوپ در مقابل انواع متاستاتیک آن قبلا مورد بحث قرار گرفته است.
بیماری های خوش خیم تخمدان
بسیاری از بیماریهای خوش خیم تخمدان که در گروه سنی بالای 40 سال دیده می شوند در بیماران 20 تا 40 سال نیز وجود دارند. اینها شامل اندومتریوم، آبسه های توبواوراین، کیستهای عملکردی ، تومورهایی باقدرت بدخیمی کم و تومورهای خوش خیم اپی تلیال و استروما- طناب جنسی هستند. این موارد قبلاً مورد بحث قرار گرفته و یا در سایر فصول به آنها اشاره خواهد شد.
تومورهای بدخیم اپی تلیال
اپیدمیولوژی
کارسینوم اپی تلیال تخمدان مسئول 80 الی 90% تمام بدخیمی های تخمدان هستند. میزان بروز آن در ایالات متحده حدود 12 الی 5 مورد در هر 100000خانم سفید پوست در مقایسه با 8 الی 20 مورد هر 100000 ساکن غیر اروپایی ایالات متحده است. تا 50 سالگی این میزان به حدود 40 درصد هزار افزایش می یابد و سپس یک رشد مجدد آهسته تا حدود 50 مورد درصد هزار نفر تا سن 65 سالگی دارد. هر چند میزان بروز در نژاد آسیایی پایین تر است ولی مطالعات نشان دهنده افزایش آن در این کشورها در سالهای اخیر می باشد. به جز نژاد سایر عوامل خطرزا که در مطالعات اپیدمیولوژیک مطرح شده شامل سن بالای 60 سال، منارک زودرس، منوپاز دیررس، نولی پاریتی، نازایی، سابقه سرطان پستان یا کولون در فرد و سابقه خانوادگی سرطان تخمدان، پستان یا کولون در فرد و سابقه خانوادگی سرطان تخمدان، پستان یا کولون می باشد. در بعضی از موارد ارثی، ریسک افزایش یافته کانسر تخمدان ممکن است به بیش از 50% نیز بالغ شود که بسته به نوع تومور و تعداد افراد مبتلا در خانواده و سن شروع بیماری دارد. سایر عوامل که در این مورد دخیل دانسته شده ولی شواهد اپیدمیولوژیک کافی به نفع آنها در دسترس نیست شامل محتوای بالای چربی در غذا، پودر تالک و استفاده از داروهای کمک باروری است. فاکتورهای حفاظت کننده عبارتند از: مصرف داروهای خوراکی ضد بارداری، بستن دوطرفه لوله ها و هیسترکتومی. آمار بدست آمده از گروه آنالیز تحقیقاتی ایالات متحده فرضیه سرکوب فعالیت تخمدانی را به عنوان عامل پیشگیری کننده از سرطان تخمدان تأیید می کند.
تومورهای اپی تلیال از اپی تلیوم سطحی تخمدان که محل تخمک گذاری است منشا می گیرند. بسیاری از عوامل خطرزا همراه با تخمک گذاری های مکرر هستند.
دریک مطالعه اخیر پیشنهاد شده که افزایش تعداد سیکل های تخمک گذاری ممکن است همراه با افزایش میزان پرولیفراسیون به واسطه تخریب DNA وافزایش خطر سرطان های اپی تلیال تخمدان که ژن P53 در آنها مثبت است شوند، ولی این مسئله در مورد کانسرهایی با ژن P53 منفی صادق نیست.
علائم بالینی
بسیاری از بیماران مبتلا به سرطان تخمدان در مرحله پیشرفته با علائم پری شکم، درد، تورم، سیری زودرس و کاهش وزن مراجعه می کنند. سایر علائم گوارشی مثل تهوع، سوء هاظمه، یبوست یا اسهال نیز ممکن است دیده شود. تورم شکم ممکن است به واسطه پارگی، پیچ خوردگی یا خونریزی داخل توده ایجاد شود. در 30% از موارد خونریزی غیر طبیعی از واژن وجود دارد. شایعترین یافته های فیزیکی عبارتند از : آسیت که به واسطه یک موج مایع و فقدان پری طبیعی شکم مشخص می شود وهمچنین وجود یک توده لگنی.این توده اغلب سفت و همراه با ندولاریته منتشر است. اگر تومور کوچک باشد ممکن است در حضور آسیب به راحتی لمس نشود. مکانهای احتمالی گسترش آن در شکم متعدد هستند(شکل49).
ارزیابی پیش از عمل
از تمام بیماران باید آزمایش کامل گلبولهای خون و شیمی سرم شامل تست های عملکرد کبدی به عمل آورد. این آزمایشات که به طور روتین قبل از عمل انجام می شوند، بیمارانی را که از نظر بیهوشی در خطر بالا قراردارند مشخص می کنند. فرضاً اختلال عملکرد کلیوی یا کبدی قبل از عمل ممکن است احتیاج به ارزیابی های بیشتر داشته باشد و یا در حضور آنمی ممکن است نیاز به کارهای تکمیلی جهت تشخیص و تزریق خون بوجود آید. شاخص های توموری را در سرم باید ردیابی کرد. هر چند CA125 تومور مارکر شایعی است که در طیف گسترده ای از بیماریهای خوش خیم و سایر بدخیمی های غیر ژنیکولوژیک بالا می رود در 80% مبتلایان به کانسر اپی تلیان تخمدان افزایش می یابد. به عنوان یک تست تشخیصی به نظر می رسد که CA125 در خانمهای
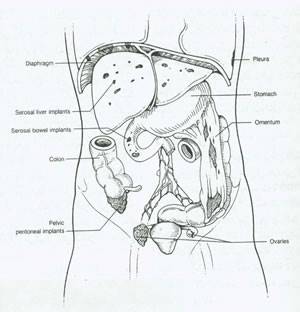
شکل 49:محل های احتمالی درگیری در کانسر اپی تلیال تخمدان.
منوپاز نسبت به قبل از منوپاز حساسیت تشخیصی بالاتری داشته باشد. تومور مارکرهای دیگری که کمترمورد استفاده قرار می گیرند عبارتند از : CA19-9 که در 0/087/5از کارسینوم های موسینوس تخمدان افزایش می یابد و آنتی ژن کارسینوم امبریونیک که در 7 الی 37 درصد از بیماران مبتلا به کانسر تخمدان بالا می رود. ارزیابی شاخص های توموری قبل از عمل می تواند در پیشگویی احتمال بدخیمی موثر باشد و در صورت بالا بودن می توان از آنها در پی گیری پاسخ به درمان و یافتن یک عود زودرس استفاده کرد.
عکس قفسه صدری به طور روتین جهت تشخیص افیوژن پلور که در 10% بیماران وجود دارد و بیماری متاستاتیک ریوی که بسیار نادر است گرفته می شود. به طور روتین از باریم انما استفاده نمی شود ولی ممکن است در بیماران مبتلا به یک توده پایین و چپ شکم، وجود خون در مدفوع، یبوست یا آنمی و یا بیماران مبتلا به کارسینوماتوز که بدخیمی های اولیه دستگاه گوارش باید در آنها رد شود مورد استفاده قرار گیرد. باریم انما وسیله تشخیص چندان مفیدی جهت پیشگویی نیاز به رزکسیون کولون نیست. انجام ماموگرافی جهت رد کردن احتمال متاستاز یا کارسینوم همزمان پستان ضروری است. هر چند که از CT اسکن به طور شایع استفاده می شود، در مقایسه با سونوگرافی لگن در ارزیابی توده های تخمدان ارجحیتی ندارد. CT اسکن به طور شایع استفاده می شود، در مقایسه با سونوگرافی لگن در ارزیابی توده های تخمدان ارجحیتی ندارد. CT اسکن به ارزیابی توده های تخمدان ارجحیتی ندارد. CT اسکن جهت مشخص نمودن سلامت کبد، درگیری لنفاتیک، امنتوم و مزانتر وسیله ای عالی به شمار می رود و همچنین می تواند در افتراق یک بدخیمی ژنیکولوژیک از یک نئوپلاسم متاستاتیک پانکراس که احتیاجی به جراحی ندارد مفید باشد. در حضور بیماری های رتروپریتوان و یا بیماری گسترده شکمی، CTاسکن می تواند بیمار را که احتیاج به یک جراح ژنیکولوژی - انکولوژی ماهر دارند مشخص کند. MRI در تشخیص توده های تخمدانی جایی ندارد، مگر در بیماران بارداری که نتایج سونوگرافی در آنها قطعی نیست و از سی تی اسکن به علت رادیاسیون نامطلوب آن نمی توان در آنان بهره گرفت.
سونوگرافی مفیدترین وسیله تشخیصی در ارزیابی یک توده لگنی است. این وسیله در دسترس و ارزان است که می تواند توصیف دقیقی از پاتولوژی تخمدان به دست دهد. مشخصاتی که به آسانی توسط سونوگرافی ارزیابی می شوند عبارتند از : حدود نامنظم، اجزاء توپر در مقایسه با اجزاء کیستیک، برجستگی های پاپیلری، درگیری دو طرفه، آسیب و درگیری پارانشیم کبدی. بعضی از این یافته ها را به کمک سونوگرافی واژینال می توان بهتر ارزیابی کرد. بعضی محققین اندکس های مورفولوژیکی را جهت تشخیص کانسر تخمدان پیشنهاد کرده اند که شامل تخمدان، ساختمان دیواره ای آن و وجود یا عدم وجود سپتوم است. استفاده از تکنیک های داپلر رنگی که میزان خون توده تخمدان را ارزیابی می کند تا حدی کمک کننده است ولی فاقد قدرت افتراق بین توده های خوش خیم و بدخیم می باشد، بنابراین هر چند در عمل به طور شایع مورد استفاده قرار می گیرد. نقش قطعی آن هنوز به روشنی مشخص نیست.
سایر مطالعات، مانند سینتی گرافی استخوان و کبد حاوی اطلاعات اضافی دیگری نیستند. IVP یا اسکن های کلیه ممکن است در بیماران مبتلا به اختلال عملکرد کلیوی یا آنان که یافته های غیر عادی در سونوگرافی دارند، مفید واقع شودولی ندرتاً مورد استفاده قرار می گیرد. ایمونوسینتی گرافی با استفاده از CYT-103 یا OC125 که متاستازهای مخفی خارج شکم یا ارزنی را ارزیابی می کند، مورد استفاده قرار گرفته ولی تنها در بیمارانی که بیماری راجعه دارند و یا قبل از جراحی نگاه دوم کمک کننده است. توموگرافی انتشار پوزیترون (PET) شکلی از تصویربرداری کامپیوتری است که از ایزوتوپ های رادیوفارماکوتیک پوزیترون استفاده می کند. از PET در مطالعات مقدماتی متعددی جهت ارزیابی قبل از عمل به منظور بررسی عود یا متاستاز کانسر تخمدان استفاده شده است. هرچند نتایج رضایت بخش بوده ولی تامین نقش قطعی آن در ارزیابی قبل از عمل چنین بیمارانی احتیاج به مطالعات گسترده تر دارد.
وضعیت تغذیه ای بیماران مبتلابه کارسینوم اپی تلیال تخمدان باید بررسی شود. مسلماً بیماران مبتلا به سوء تغذیه در معرض خطر افزایش یافته عوارض بعد از عمل هستند که منجر به بستری طولانی تر در بیمارستان و افزایش هزینه ها می شود. یک راه برطرف کردن این مشکل استفاده از تغذیه وریدی قبل از عمل (TPN) است. در یک مطالعه بزرگ آینده نگر تصادفی که توسط گرون مطالعاتی و ترانس منتشر شد متوجه شدند که استفاده طولانی مدت (بیش از 7روز) از TPN با افزایش بروز پنومونی، عفونت زخم و عوارض عفونی بعد از عمل همراه بوده است. به علاوه در گروهی که TPN شدند میزان مرگ و میر کاهش نیافت. آنها نتیجه گیری کردند که TPN تنها در کمتر از 0/05 بیماران مفید بوده و غربالگری دقیق جهت تامین بیماران مبتلا به سوء تغذیه شدید لازم است.
مرحله بندی
مرحله بندی ، نقش مهمی در درمان کانسرهای تخمدان، به خصوص کارسینوم اپی تلیال آن دارد. این کار در زمان عمل جراحی بر طبق سیستم توصیه شده FIGO در سال 1987 انجام می شود (به جدول 4 مراجعه شود). باید حتماً از مرحله بندی کامل استفاده کرد چون روی پروگنوز و متد درمانی انتخاب شده تاثیر می گذارد (به جدول 3 مراجعه شود). برطبق مطالعات توصیفی مشخص شده که 0/030 از بیمارانی که تصور می شد درزمان جراحی اولیه در مرحله I یا II بیماری قرار دارند، در لاپاراتومی و مرحله بندی مجدد بیماری پیشرفته تری داشتند.
توصیه می شود از یک برش عمودی در خط وسط که در صورت لزوم تا بالای ناف امتداد می یابد استفاده شود تا بتوان به قسمت فوقانی حفره شکم دست یافت. اگر به طور اتفاقی از طریق برش عرضی تحتانی شکم با کانسر تخمدان مواجه شویم باید عضله رکتوس قطع شود و یا از سمفیز پوبیس جدا شود. باید از برش های به شکل J اجتناب کرد مگر اینکه جراح هیچ چاره دیگری نداشته باشد.
تومورهای سروز
این تومور شایعترین تومور اپی تلیال تخمدان است و حدود 40 تا 50% تومورهای تخمدان را شامل می شود. در اکثر بیماران (50 الی 60درصد) تومور سروز دو طرفه است و در زمان تشخیص منتشر شده. از لحاظ ظاهری تومورهای از اندازه میکروسکوپی تا 20 سانتی متری متغیر هستند. آنها نرم، شکننده، اکثراً کیستیک و چند حفره ای هستند که حاوی مایع خونی یا کدر بوده و برجستگی های پاپیلری متعدد دارند همچنین ممکن است این برجستگی های پاپیلری در سطح خارجی آنان درساختمان های مجاور آن دیده شود(شکل50).
ارزیابی میکروسکوپی در کارسینوم سروز خوب تمایز
یافته نشان دهنده ساختمان های پاپیلری است که در داخل فضاهای کیستیک رشد کرده و یا در سطح پریتوان تومور قرار دارند. اجسام Psammoma در اکثر موارد یافت می شوند (شکل51). در تومورهایی با تمایز کمتر، الگوی پاپیلری کمتر دیده می شود و فعالیت میتوزی مشهودتر است و تومور به صورت صفحات جامدی از سلول های تیره متحدالشکل در می آید که اغلب مختصراً دوکی هستند و نسبت هسته به سیتوپلاسم در آنها بالاست. علاوه بر این، ممکن است سلول های غول آسای تک هسته ای یا شبیه سن سیشیوم بد شکل نیز در بسیاری از تومورهای با تمایز ضعیف دیده شوند.
تومور موسینوس
کارسینوم موسینوس 5 تا 10 درصد از تمام بدخیمی های تخمدان را در بر می گیرد و در 15 الی 20درصد موارد دو طرفه است. نسبت به نوع سروز اشکال منتشر در آن کمتر دیده می شود. کارسینوم موسینوس معمولاً از نوع سروز بزرگتر بوده و به طور متوسط 15 الی 30 سانتی متر قطر دارد. تومور چند حفره ای و جامد و کیستیک بوده و حاوی موسین چسبنده و غلیظ است.
از لحاظ میکروسکوپی، کارسینوم مهاجم خوب تمایز یافته موسینوس به طور تیپیک از سلول های شبه روده ای تشکیل شده است (شکل 52). ممکن است در آن تنها، مختصری نامنظمی در شکل غدد وجوانه های سلولی دیده شود بدون اینکه علامت دیگری از تهاجم به استروما وجود داشته باشد. تولید موسین به وضوح دیده می شود. در کارسینوم با تمایز متوسط ، غدد بیشتر به هم فشرده هستند و تهاجم به استروما آشکار است. مطبق شدن سلولی و آتیپی هسته نیز به چشم می خورد. در کارسینوم با تمایز ضعیف، سلول ها بد شکل و نامنظم بوده و در یک استرومای متراکم محصور شده اند. ممکن است سلولهای نگین انگشتری وجود داشته باشند. همانطور که در تومور کروکنبرگ با آنها مواجه می شویم، معمولاً تومور موسینوس حاوی طیف وسیعی از تمایز بافتی است بنابراین جهت تشخیص صحیح باید نمونه برداری گسترده بافتی انجام شود.
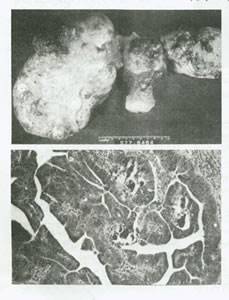
شکل 50:کارسینوم سروز .تومور به صورت توده های بزرگ،دو طرفه،جامد و کگیستیک بوده که در داخل کپسول رشد کرده و سروز رحمی را نیز درگیر می کنند.
- شکل 51:کارسینوم سروز .در این تومور پاپیلاها با سلول های درجه بالای تومور و واجد هستک های واضح پوشیده شده اند.اجسام نیز حضور دارند.
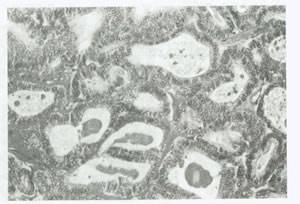
شکل 52:کارسینوم موسینوس .غده متراکم و انفیلتره کننده توسط سلول های استوانه ای بلند با سیتو پلاسم روشن مفروس شده اند.به هسته آتیپیک مطبق توجه کنید (بزرگنمایی 160×).
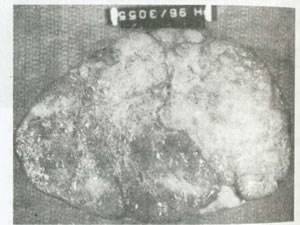
شکل 53:کارسینوم اندومتروئید .رنگ تومور در محل های نرم تر و شکننده تر طلایی -قهوه ای است.
تومور اندومتروئید
این تومور مسئول 0/020 از تمام بدخیمی های اپی تلیال تخمدان است و دومین نوع شایع کارسینوم اپی تلیال تخمدان می باشد. در 0/030 از موارد با اندومتریوز در همان تخمدان یا نقاط دیگر در لگن واقع است. همچنین، در 20% موارد یک آندوکارسینوم اندومتر به طور همزمان با آن دیده می شود. این تومورها معمولاً کوچک وسطحی بوده و همراه با هیپرپلازی اندومتر هستند.
از لحاظ ظاهری،این تومور نرم و صاف بوده و از 12 تا 20 سانتی متر قطردارد. در سطح برش یافته، هم اجزاء جامد و هم کیستیک همراه با برجستگی های پولیپی و موسین ممکن است در آن دیده شوند(شکل 53). مشابه آدنوکارسنیوم اندومتر، آدنوکارسینوم اندومتروئید تخمدان با تمایز خوب توسط غددی که با اپی تلیوم چند لایه یا مطبق کاذب بلند و استوانه ای پوشیده شده، مشخص می شود (شکل 54). تمایز اسکواموس ممکن است در 0/030 تومورها دیده شود و معمولاً خوش خیم است. اگر تومور تمایز کمتری یافته باشد، الگوی غددی نامنظم تر شده و یک الگوی رشد جامد غالب می شود، میتوز فراوان تربوده و درجه بدخیمی هسته ها بالاتر است.
تومورسلول روشن
این تومورها 5 الی 10درصد تومورهای بدخیم اپی تلیال تخمدان را تشکیل می دهند در 15 تا 20 درصد ازبیماران دو طرفه و در 60درصد موارد محدود به تخمدان است. این محدودیت گاهی سوال برانگیزاست چون تومور سلول روشن از لحاظ بیولوژیک حتی در مرحله I یک تومور مهاجم است. اغلب همراه با اندومتریوز بوده و 25% از تومورها از جدار کیست های اندومتریوتیک منشاء می گیرند. یک فرم مختلط از کارسینوم اپی تلیال تخمدان همراه با تومور سلول روشن و کارسینوم سروز یا اندومتروئید می تواند رخ دهد که نشان دهنده یک منشا مشترک بافتی است.
از لحاظ ظاهری، این تومور می تواند تا 30 سانتی متر هم رشد کند و قطر متوسط آن 15 سانتی متر است و معمولاً کیستیک می باشد. هرچند به طور مکرر در آن چسبندگی دیده می شود بیشتر از نوع التهابی است تا نئوپلاستیک. در برش بافتی برجستگی های پاپیلری، پولیپ و یا ندول های گوشتی زرد رنگ که به دیواره ضخیم کیست تهاجم یافته اند دیده می شوند. از لحاظ میکروسکوپی، تومور سلول روشن
ممکن است توسط صفحات سلول های روشن چند وجهی که توسط دیواره هایی از بافت همبند ظریف جدا شده اند مشخص شود. سلول ها اغلب حاوی مقادیر زیادی گلیکوژن در داخل سیتوپلاسم هستند که مسئول ظاهر روشن آنها می باشد. یک نوع دیگر الگوی توبولوپاپیلری است که با سلول های استوانه ای ترشحی همراه با هسته هایی که به داخل مجرای غدد برجسته شده اند، مشخص می شود ویک نمای شبیه به میخ سرپهن دارند (شکل55). سلول های ائوزینوفیل ممکن است به جای سلول های ترشحی استوانه ای توبول ها یا پاپیلاها را احاطه کنند ویا شاید مخلوطی از هردو سلول وجود داشته باشد.
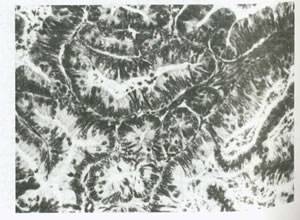
شکل 54:کارسینوم اندومتروئید .در یک نوع خوب تمایز یافته آن غدد صاف و گرد بوده و متراکم هستند و توسط اپی تلیوم استوانه ای نوع اندومتروئید مفروش شده اند.
تومورهای نامتمایز
در حدود 5 الی 10 درصد ازتمام بدخیمی های تخمدان، تومورهای نامتمایزی هستند که چنان تمایز ضعیفی دارند که در هیچ یک از گروه بندی هایی که ذکر آن رفت جای نمی گیرند. الگوی بافت شناسی در این موارد متغیر است و شامل صفحات سلول های بزرگ آناپلاستیک تا سلول های کوچک نامتمایز و یا سلول های بزرگ غول آسای چند شکلی با سیتوپلاسم ائوزینوفیل می باشد. معمولاً پیش آگهی بسیار ضعیف است چون اغلب بیماران در مراحل پیشرفته همراه با تومورهای بزرگ خود را نشان می دهند.
تومور برنر
تومور بدخیم برنر بسیار نادر است (به «توموربرنر» در بالا مراجعه شود). 10 تا 30 سانتی متر قطردارد و معمولاً یک طرفه است. در برش بافتی اجزای توپرو کیستیک دیده می شود، که حاوی ندول های دیواره ای پولیپ مانند و شکننده است. به لحاظ میکروسکوپیک، تومور بدخیم برنر حاوی صفحات توپر سلولی از سلولهای هتروژن اپی تلیال است که استرومای اندکی دارند. درجه سلولی فعالیت میتوزی به وفور دیده می شوند. تشخیص افتراقی از یک کارسینوم با منشاء دستگاه ادراری براساس تظاهرات کلینیکی و یافته های جراحی است. منشاء تخمدانی آن براساس یافتن یک ناحیه تغییر از یک تومور برنر خوش خیم با پرولیفراتیو مشخص می شود.
تومورهای مزانشیمال و مختلط مولرین
تومورهای نادر تخمدانی هستند که به زیرگروههایی تقسیم می شوند که شامل آدنوسارکوم و تومورهای بدخیم مختلط مزودرمال هستند که با پیش آگهی ضعیفی همراهند. از لحاظ بافت شناسی به انواع رحمی خود شبیه هستند. آدنوسارکوم معمولاً ده سانتی متر قطر داشته و شامل یک جزء خوش خیم اپی تلیال و یک جزء سارکوماتوز مزانشیمال می باشد. تومورهای بدخیم مختلط حاوی هر دونوع سلول بدخیم اپی تلیال و مزانشیمال هستند (به نام کارسینوسارکوم).
مشابه تومورهای اپی تلیال تخمدان، این تومورها معمولاً در هنگام جراحی طبقه بندی می شوند. با این وجود برداشتن حجم عمده تومور و شیمی درمانی متعاقب آن ممکن است به اندازه تومورهای اپی تلیال مؤثر نباشد.
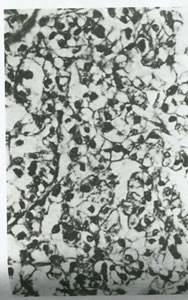
شکل 55:در کارسینوم سلول روشن،سلول های تومور چند وجهی همراه با هسته های مرکزی و سیتو پلاسم روشن فراوان هستند (بزرگنمایی250X).
رژیم شیمی درمانی متفاوت هستند ولی به علت نادر بودن این تومورها مطالعات کافی در دسترس نیست. عواملی که تاکنون استفاده شده شامل دوکسوروبیسین (آدریاماسین)، سیس پلاتین وایفوسفامید (IFEX) می باشند.
درمان
جراحی
جراحی مهمترین و اولین قدم در بیماران مبتلا به کانسر اپی تلیال تخمدان است. جراحی به تنهایی در بیماران مبتلا به مرحله I درجه I تا II کارسینوم تخمدان درمان کننده است. در مراحل پیشرفته تر، جراحی باعث قطعی شدن تشخیص شده و می تواند از طریق آن مرحله بندی دقیقی از بیماری بدست آورد و کاهش حجم تومور را انجام داد تا حتی الامکان کمتر ازیک سانتی متر از بافت آن باقی بماند. یک سالپنگواوفورکتومی یک طرفه همراه با مرحله بندی دقیق تنها در بیماران جوان مبتلا به مرحله I و درجه I تا II پیشنهاد می شود که خواهان حفظ قدرت باروری خود هستند. باید تخمدان مقابل را به دقت ارزیابی کرد، چون 5% خطر یک متاستاز پنهان و یا یک کارسینوم مجزای اولیه وجود دارد. بیوپسی از تخمدان مقابل توصیه نمی شود مگر اینکه درگیری واضح غیر عادی وجود داشته باشد. این بیماران را باید بعداً تحت پیگیری دقیق قرار داد. هرچند در مورد زنانی که برداشتن تخمدان باقیمانده شده است، این توصیه بر پایه مطالعات کلینیکی کنترل شده نیست.
کاهش حجم تومور به طور اولیه بیش از دو دهه است که پیشنهاد شده است. این براساس این تئوری است که برداشتن تومورهای بزرگ هیپوکسیک باعث نفوذ بهتر عوامل شیمی درمانی به بافت باقیمانده آن می شود کاهش حجم تومور به میزان مطلوب وقتی است که بافت باقیمانده کمتر از یک سانتی متر باشد. گزارشات متعددی در طی این 20 سال نشان دهنده این است که قطر بزرگترین بافت باقیمانده با میزان پاسخ دهی به درمان، دوره های بدون رشد تومور و بقای عمر کلی بیمار در ارتباط است.
گروه انکولوژی زنان (GOG) میزان بقاء را در رابطه با بزرگترین قطر باقیمانده تومور ارزیابی کرد(پروتکل 52 و 97) و دریافت که میزان بقای 4 ساله در بیمارانی که بافت باقیمانده تومور 2 سانتی متریا بزرگتر است حدود 20% می باشد. در حالیکه در آنان که تنها بیماری میکروسکوپی باقیمانده دارند، 60% است. در بیمارانی که بافت باقیمانده کوچکتر از 2 سانتی متر است میزان بقای 4 ساله 40% است. یک مطالعه دیگر توسط GOG (پروتکل 52) انجام گرفت که میزان بقای مرحله III بیماری را در کسانی که تومور داخل شکمی در زمان اولین عمل جراحی یک سانتی متر یا کمتر خطر داشت را با کسانی که توسط جراحی حجم تومور شان به زیر یک سانتی متر تقلیل یافته بود مقایسه کرد. نتیجه این بود که بیمارانی که قبل از عمل حجم توموریک سانتی متر یا کمتر داشتند در مقایسه با گروه سیتورداکشن میزان بقای بالاتر داشتند. سن بیمار، درجه تمایز تومور و تعداد ندول های تومور نیز از عوامل دخیل در پیش آگهی هستند و بنابراین ملاحظه می کنیم که فاکتورهایی که «بیولوژی تومور» را کنترل می کنند نیز در تامین میزان بقای بیماران و پاسخ دهی وی به عمل موثر بوده و می توانند بیشتر از مهارت جراحی نقش داشته باشند.
پس از انجام شیمی درمانی ، بیمارانی که از لحاظ بالینی بیماری در آنها پسرفت کرده است ممکن است از یک لاپاراتومی نگاه دوم جهت تعیین میزان موفقیت درمان سود ببرند که در این عمل حضور هر بافت باقیمانده ای بررسی می شود. هدف از نگاه دوم تامین بیماری باقیمانده است که در صورت وجود درمان ادامه یافته و طول عمر افزایش می یابد. می توان یا کار را از طریق لاپاراسکوپ انجام داد تا طول زمان بستری در بیمارستان کاهش یابد ولی این کار تنها زمانی توصیبه می شود که جراح از مهارت کافی برخوردار بوده و باید تمام حفره شکم وفضای رتروپریتوان کاملاً در بیمار بررسی شود. هر چند می تواند ابتدا از یک لاپاراسکوپی تشخیصی استفاده کرد و اگر بیماری ماکروسکوپی وجود داشت لاپاراتومی انجام داد. درمطالعات قدیمی تر نشان داده شده که میزان بقا در بیمارانی که تحت جراحی نگاه دوم قرار گرفتند در مقایسه با آنان که این عمل در آنها صورت نگرفت هیچ تفاوتی نداشت و بنابراین هیچ سودمندی جهت این کار قائل نشدند. ولی در این مطالعات اثر شیمی درمان های جدید تر ودرمان های کمکی موثرتر بررسی نشده بود. بنابراین جراحی نگاه دوم در حال حاضر تنها محدود به مطالعات کلینیکی است که کارایی عوامل جدیدتر خط اول درمانی و درمان های کمکی در افزایش میزان بقا را بررسی می کنند.
کاهش ثانویه حجم تومور در زمان لاپاراتومی نگاه دوم نیز در مطالعات متعددی بررسی شد که نشان دهنده سود بخشی این کار در گروهی از بیماران است که بیماری ماکروسکوپی آنها به نحو موفقیت آمیزی به تومور میکروسکوپی تقلیل یافته است. البته ممکن است حضور بیماری ماکروسکوپی تا زمان عمل جراحی مشخص نشود و بنابراین بسیاری از بیماران تحت یک عمل جراحی غیر ضروری قرار گیرند. بنابراین تا زمانی که آزمایشات تشخیصی دقیق تری جهت برآورد بیماری مارکروسکوپی باقیمانده بعد از درمان استاندارد در دسترس نیست، کاهش حجم ثانویه تومور نقش درمانی مهمی در کارسینوم تلیال تخمدان ندارد، مگر به عنوان بخشی از پروتکل های تحقیقاتی.
بعد از انجام شیمی درمانی کمکی جدید، جراحی کاهنده حجم تومور در بیماران مبتلا به کانسر پیشرفته تخمدان انجام شده است ولی هنیوز مورد اختلاف نظر می باشد.
گروه کانسر زنان با سازمان اروپایی تحقیقات و درمان کانسر همکاری می کند اخیرا یک مطالعه بزرگ تصادفی بر روی 278نفر انجام داد. تمام بیماران تحت 3 دوره درمان با سیکلوفسفاماید و سیس پلاتین قرار گرفتند و سپس به طور اتفاقی به دو گروه تقسیم شدند که تحت عمل جراحی کاهنده حجم تومور قرار گرفتند ویا نگرفتند وسپس این بیماران سه دوره اضافی شیمی درمانی نیز دریافت کردند. نتیجه این مطالعه این بود که انجام جراحی کاهنده حجم، سودبخشی قابل ملاحظه ای که به لحاظ آماری معنی دار است در افزایش دوره زمانی خالی از بیماری و میزان بقای کلی بیماران در کانسر اپی تلیال پیشرفته تخمدان دارا می باشد و میزان کل بقا را به طور متوسط تا شش ماه افزایش می هد. هر چند این تفاوت زیاد نیست و باید توسط مطالعات بیشتر اثبات شود. به نظر می رسد که برخی از بیماران که نمی توان حجم تومور را در هنگام عمل جراحی اولیه در آنها کاهش داد، کاهش حجم تومور با فاصله زمانی سودمند باشد. هر چند در این مطالعه مقایسه ای بین بیمارانی که کاهش حجم تومور به طور اولیه درآنها صورت گرفته با آنان که این عمل با یک فاصله زمانی انجام شده صورت نگرفت.
جراحی ثانویه ی کاهنده حجم تومور در بیماران مبتلا به کارسینوم عود کننده اپی تلیال تخمدان نیز در مطالعات متعددی بررسی شده است.اکثر این گزارشات نشان هنده این است که بهبود قابل ملاحظه ای در بیمارانی که تحت عمل کاهنده حجم به علت عود بیماری می برند که یک سال یا بیشتر وقفه زمانی پسرفت بیماری در آنها وجود داشت که باز هم تایید کننده نقش خصوصیات بیولوژیک این تومورها در تعیین پیش آگهی است.
شیمی درمانی
بعد از جراحی ، اغلب بیماران احتیاج به شیمی درمانی خواهند داشت. تنها در بیماران با مرحله I و درجه Iتومور احتیاج به درمان اضافه ای وجود ندارد .هنوز واضح نیست که احتیاج به درمان اضافه دارند یا خیر. در مطالعات GOG و گروه ایتالیایی که با گروه انکولوژی زنان همکاری می کند (GICOG) تفاوتی در میزان بقا (بیش از 80درصد) بین بیمارانی که شیمی درمانی (ملفالان [الکران] یاسیس پلاتین) با فسفر 32 داخل پریتوان دریافت کردند و کسانی که دریافت نکردند مشاهده نشد. دریک مطالعه تصادفی دیگر که توسط GICOG انجام شد کارایی 6 دوره درمان با سیس پلاتین را در 186 بیمار در مقایسه با عدم انجام درمان ارزیابی شد و مشاهده کردند که تفاوت معنی داری در میزان بقای خالی از بیماری 5 ساله (سیس پلاتین 83% در مقابل عدم درمان 64% ) وجود دارد ولی در میزان بقای کلی تفاوتی مشاهده نشد. هر چند درمورد لزوم درمان این بیماران و همچنین بهترین عامل درمانی بحث و اختلاف نظر وجود دارد ولی هیچ شکی نیست که بیماران با مرحله cI یا بالاتر قطعاً احتیاج به درمان دارند.
عوامل شیمی درمانی متعددی که بر علیه کانسر تخمدان موثر هستند شناخته شده اند. موثرترین رژیم درمانی سپس پلاتین تنها و یا درمان ترکیبی بر پایه سیس پلاتین است. سایر عوامل موثر عبارتند از : Paclitaxel، توپوتکان هیدروکلراید Hycamitn، دوکسوروبیسین، سیکلوفسفاماید،
ایزوفوسفاماید، اتوپوزاید و آلترتامین (Hexalen). هر چند میزان کلی پاسخ به درمان در رژیم های ترکیبی (بیش از 50%) افزایش می یابد، هنوز شواهد کافی جهت اثبات میزان کلی بقایای بالاتر در این بیماران، در مقایسه با درمان تک عاملی با سیس پلاتین وجود ندارد.
اخیراً شناخته شده که Paclitaxel، که تثبیت کننده میکروتوبول هاست فعالیت قابل توجه ای در بسیاری از کانسرها از جمله کارسینوم اپی تلیال تخمدان دارد. در سال 1996، GOG مقاله ای را منتشر کرد که مقایسه ای بود بین کارایی پاکلی تاکسل و سیس پلاتین درمقابل سیکلوفسفامید و سیس پلاتین به عنوان درمان کمکی خط اول در بیماران مبتلا به مرحله III یا IV کانسر اپی تلیال تخمدانی که به نحو مطلوب عمل جراحی کاهنده حجم در آنها صورت نگرفته بود. میزان بقای عادی از بیماری و میزان بقای کلی در گروه پاکلی تاکسل- سیس پلاتین به طرز معنی داری بالاتر از گروه سیکلوفسفامید - سیس پلاتین بود (میزان بقای متوسط 38 تا 24 ماه) ولی عوارض سمی نیز بیشتر بود. اگر این رژیم در بیمارانی که قسمت عمده ای از تومور در آنها باقی مانده، موثرتر باشد، باید برای بیماران مبتلا به سرطان پیشرفته که عمل کاهنده حجم تومور را به طور مطلوب داشته اند نیز به همان اندازه سودمند باشد. مطالعات بیشتری توسط GOG در دست انجام است که کارآیی جایگزین برای سیس پلاتین را به نام کاربوپلاتین (پاراپلاتین) در مقایسه با سیس پلاتین در این رژیم درمانی ترکیبی و همچنین یک متد درمانی با تزریق 3ساعته، کار از لحاظ اقتصادی به صرفه تر است را تحت بررسی دارد.
GOG در مطالعه ای برروی 132 بیمار درمان تک عاملی با پاکلی تاکسل (درعرض 24ساعت)، درمان تک عاملی سیس پلاتین و همچنین ترکیبی از درمان 24 ساعته پاکلی تاکسل - سیس پلاتین را به عنوان درمان کمکی بیماران مراحل پیشرفته که به طور بهینه حجم تومور در آنها انجام نشده بررسی کرد.
بیمارانی که پاکلی تاکسل تنها دریافت کردند دوره های عاری از بیماری پائین تری در مقایسه با دیگر گروهها داشتند ولی میزان کلی بقا در تمام بیماران مشابه بود که به علت درمان متقاطع است. این مطالعه پیشنهاد می کند که پاکلی تاکسل به تنهایی به اندازه سیس پلاتین یا ترکیبی از سیس پلاتین - پاکلی تاکسل موثر نیست.
بعد از پاکلی تاکسل، بسیاری از داروهای جدید دیگر توسط سازمان غذا و داروی آمریکا (FDA) به عنوان رژیم درمانی خط دوم در کانسر تخمدانی مورد تایید قرارگرفته اند. این داروها شامل: توپوتکان، ژمیستابین هیدروکلراید Gemzar، و ینورلبین تا تارترات (Navelbin) و تزریق دوکسوروبیسین هیدروکلراید لیپوزوم (Doxi) هستند. Topotecan که یک منع کننده توپوایزومر است، در مطالعات محدودی اندکی موثر از پاکلی تاکسل دردرمان کانسرهای عود کننده یا مقاوم تخمدان شناخته شده است. ولی جهت جایگزینی توپوتکان و سیس پلاتین به جای پاکلی تاکسل و سیس پلاتین در خط اول درمانی احتیاج به مطالعات تصادفی گسترده تری است.
شیمی درمانی - Neoadjuvent جهت کاهش حجم تومور قبل از انجام لاپاراتومی در دست تحقیق است. بر اساس آزمایشات غیرتهاجمی که امروزه در دست تحقیق است. براساس آزمایشات غیر تهاجمی که امروزه در دسترس است، پیش بینی دقیق اینکه کدام یک از بیماران کاندیدای مناسبی جهت کاهش حجم موفقیت آمیز تومور نیستند، دشوار می باشد. علاوه بر آن، درمان نئوادجاونت تنها در مطالعات توصیفی گذشته نگر کوچکی مورد بررسی قرار گرفته است. هر چند استفاده از آن منجر به درمان کاهنده سلول موفقیت تحت مطالعه تخمین اینکه آیا با میزان بقای بالاتری نیز همراه است یا خیر مقدور نیست.
در گروه انتخاب شده ای از بیماران درمان داخلی پریتوان ممکن است سودمند باشد. این کار باعث می شود که تومور تحت تماس مستقیم با غلظتی از دارو قرار گیرد که شاید ده تا هزار برابر بیشتر از آن باشد که با درمان سیستمیک به دست می آید. خصوصیات یک داروی ایده آل عبارتست از : حداقل ایجاد سمیت موضعی در پریتوان، یک منحنی خطی دوز - پاسخ، نفوذپذیری اندک در پریتوان، پاکسازی سریع از خون و فعالیت سریع الاثر بدون اینکه احتیاج به تبدیل به یک فرم فعال داشته باشد. علاوه بر آن بیماران باید حداقل چسبندگی داخل پریتوان را داشته باشند تا دارو به انتشار موضعی خوبی دست یابد و همچنین حجم بافت تومور کوچک به انتشار موضعی خوب دست یابد و همچنین حجم بافت تومور کوچک و ترجیحاً میکروسکوپی یا کمتر از پنج میلی متر یا کمتر، درمان بیمارانی که در جراحی ثابت شده پاسخ کامل به شیمی درمانی داده اند و درمان اولیه بیماران با بیماری پنج میلی متر یا کمتر، درمان بیمارانی که در جراحی ثابت شده پاسخ کامل به شیمی درمانی داده اند و درمان اولیه بیماران مبتلا به تومورهایی با درجه بدخیمی بالادر مراحل اولیه بیماری و یا به عنوان درمان ترکیبی کمکی همراه با تزریقات سیستمیک. داروهایی که از این طریق استفاده شده اند شامل: سیس پلاتین، کاربوپلاتین، میتوکسانترون هیدروکلراید (Nocatrone)، دوکسوروبیسین و میتومایسین (موتامایسین) هستند. پاکلی تاکسل اخیراً در مطالعات زیادی مورد بررسی قرار گرفته و تا حدی کارایی داشته است. در مطالعات مقدماتی،N)AD35 - تری فلورواستیل است، نسبت به دوکسوروبیسین از نظراثرات سمی و فعالیت ضد تومور ارجح دانسته شده است. یک مطالعه فاز اول با استفاده ازAD32 به عنوان درمان داخل پریتوان در بیماران مبتلا به کانسرژنیکولوژی که محدود به شکم بود صورت گرفت. در این بیماران درمان استاندارد با شکست مواجه شده بود و به نظر می رسد که دارو به خوبی تحمل شده و می توان به نحو بی عارضه ای مورد استفاده قرار گیرد. مطالعات بیشتری جهت بررسی کارآیی آن در بیماران انتخاب شده در دست انجام است.
اخیراً یک مطالعه تصادفی منتشر شد که در آن کارایی سیس پلاتین داخل پریتوان همراه با سیکلوفسفاماید داخل وریدی در مقایسه با سیس پلاتین داخل وریدی و سکلو فسفاماید در درمان مرحله III کانسرتخمدان که به نحو مطلوب تحت کاهش حجم تومور قرار گرفته بودند (ندول های باقیمانده کمتر از 2 سانتی متر) مقایسه شده بود. نتیجه آن بود که برتری قابل توجه ای از نظر میزان بقا و مسمومیت زایی کمتر در بیمارانی که تحت درمان سیس پلاتین داخل پریتوان قرار گرفتند با یک طول عمر متوسط 49 ماهه در مقابل 41 ماه در گروه دیگر مشاهده شد.(شکل 60)
این مطالعه پیشنهاد می کند که ترکیب سیس پلاتین داخل پریتوان همراه با یک عامل داخل وریدی به عنوان درمان اولیه ممکن است سودمند باشد. با این وجود، بهترین رژیم درمانی داخل پریتوان هنوز مشخص نشده و احتیاج به مطالعات تصادفی بیشتری جهت مقایسه آن با سایر روش های درمانی دارد. اخیراً GOG در حال انجام یک مطالعه فاز III که استفاده داخل پریتوان یا داخل وریدی سیس پلاتین همراه با کلی تاکسل داخل وریدی را بعد از جراحی کاهنده حجم تومور، مقایسه می کند.
رادیاسیون
در بیماران انتخاب شده ای که حجم کوچک یا میکروسکوپی بافت تومور پس از عمل جراحی دارند، از رادیاسیون شکمی لگنی استفاده شده است. به استثنای فسفر32 در ایالات متحده، درمان با رادیاسیون به عنوان درمان کمکی در کانسر تخمدان درمان شایعی نیست. دریکی از بزرگترین مطالعات انجام شده که توسط گروه تورنتو درمان مرحله II و III بیماران از رادیاسیون شکم و لگن استفاده شد، یک بقای 10ساله عاری از بیماری در 38درصد بیماران (n=91) که بافت باقیمانده بالای دو سانتی متر داشتند، مشاهده شد. جزئیات رادیوتراپی در فصل 53 مورد بحث قرار گرفته است.
پیش آگهی
علی رغم اضافه شدن رژیم درمانی متعددی که میزان بقاء را در بیماران مبتلا به سرطان اپی تلیال تخمدان افزایش داده است، هنوز پیشرفت قابل ملاحظه ای در درمان مبتلایان به کانسر پیشرفته تخمدان به دست نیامده است. میزان بقای کلی 5ساله ممکن است افزایش یافته باشد ولی هنوز در حدود 42% است. باید تحقیقات هم در زمینه علوم پایه و هم علوم بالینی ادامه یابد چون فهم صحیح اتیوپاتوژنز بیماری می تواند درپیشرفت متدهای پیشگیری، غربالگری به منظور تشخیص زودرس و درمان بهتر کمک کننده باشد.
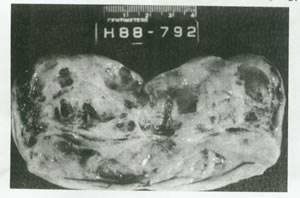
شکل 61:تومور سلول گرانولوزا .سطح برش یافته نرم،زرد رنک و تو پر و کیستیک است و کیست ها حاوی لخته های خون هستند.
تومورهای استروما - طناب جنسی
تومور سلول گرانولوزا
نوعی از تومور گرانولوزا که در بالغین رخ می دهد مسئول 1 تا 2 درصد از تمام تومورهای تخمدان و 95% از تمام تومورهای سلول گرانولوزا است. هرچند قطر این تومورها به طور متوسط به ده الی دوازده سانتی متر می رسد، اغلب یک توده لگنی قابل لمس وجود ندارد. اوج شیوع سنی آن 50 تا 55 سال و اکثر آنها استروژن تولید می کنند که در سنین قبل از یائسگی با بی نظمی های قاعدگی مثل منوراژی، آمنوره به علت عدم تخمک گذاری یا متروراژی خود را نشان می دهد. در زنان یائسه، خونریزی واژینال به علت تحریک اندومتر رخ می دهد. هیپرپلازی یا کارسینوم اندومتر یافته شایعی است که دو برابرمیزانی که در خانمهای قبل از یائسگی وجود دارد دیده می شود نزدیکترین تخمین جهت فرکانس کانسر همزمان اندومتر 0/05است.
از لحاظ ظاهری، تومور توپر بوده و رنگ زرد یا خاکستری سفید دارد وحاوی مناطق کیستیک و خونریزی است (شکل 61). در مطالعه میکروسکوپی آنها از سلول های گرانولوزا وتکا یا فیبروبلاست ها و یا هردو تشکیل شده است.
به نظرمی رسد که سلولهای تکا و فیبروبلاست ها به احتمال قوی پاسخی از استروما به پرولیفراسیون گرانولوزا هستند، چرا که در مناطق متاستاتیک تنها سلول های گرانولوزا حضور دارند. سلول های گرانولوزا ممکن است گرد، چند وجهی یا دوکی شکل باشند و سیتوپلاسم اندک و هسته های گرد یا بیضوی دارند. ممکن است الگوهای بافت شناسی مختلف به طور همزمان یا مجزا دیده شوند که شامل الگوی میکروفولیکولار همراه با اجسام Call-Exner (شکل 62)، ماکروفولیکولار، انسولار (Insular)، ترابکولار، توپر- مجرایی و ندرتاً الگوی توبولی توخالی باشند. فرم های با تمایز کمتر شامل الگوی منتشر یا Watered-Silk هستند. ندرتاً ممکن است تومور تحت ترانسفورماسیون سارکوماتوز قرار گیرد و تهاجمی ترین شکل بیماری را ایجاد کند.
هرچند اغلب تومورهای سلول گرانولوزا پتانسیل اندکی برای رفتار بدخیم دارند و اکثر آنها (0/090) در مرحله I هستند ولی تمایل به عود دیررس، در طی 10 تا 20سال یا بیشتر پس از تشخیص اولیه دارند. علاوه بر مرحله بندی دقیق جراحی(به جدول III مراجعه شود) جراحی باید شامل یک هیسترکتومی کامل شکمی و سالپنگواوفورکتومی دو طرفه در بیماران منوپاز باشد. اگر تومور محدود به یک تخمدان باشد، می توان در بیماران جوانتر از جراحی محافظه کارانه جهت حفظ قدرت باروری استفاده کرد. به نظر می رسد مهمترین عامل دخیل در پیش آگهی دیگری نیز شناخته شده اند که شامل، پارگی کپسول تومور، سایز تومور، آتیپی هسته ای، فعالیت میتوزی و الگوی بافتی هستند. مطالعات در مورد این عوامل نتیجه قطعی به دست نداده است. برآورد کارایی شیمی درمانی در این گروه از تومورها دشوار است. بیشترین مطالعات گذشته نگر به علت تعداد محدود نمونه و پیگیری کوتاه مدت کافی نبوده اند. گزارش شده که درمان بر پایه پلاتی نیوم شامل VBP, PAC و BEP بهترین وموفقیت آمیز ترین نوع درمان با طور عمر 5 ساله 0/050می باشد. همچنین در مطالعات کوچکی با تعداد محدود از رادیوتراپی با میزان متغیری از موفقیت استفاده شده است. از شیمی درمانی و رادیاسیون نیز در این زمینه استفاده شده است.
درمان یک توده تخمدانی
جراحی در مقابل درمان محافظه کارانه،
لاپاروسکوپی در مقابل لاپاراتومی.
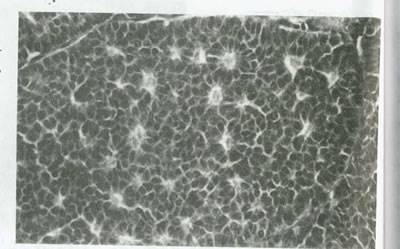
شکل 62:تومور سلول گرانولوزا .الگوی میکروفولیکولار توسط سلول های گرانولوزا با هسته های زاویه دار که حفره های کوچکی حاوی اجسام call-Exnerرا در فولیکول های در حال رشد تحریک می کند ،مشخص می شود.
خطر یک نئوپلاسیم بدخیم تخمدان در یک خانم قبل از یائسگی 0/013 است. بسیار مهم است که پزشک بتواند بیمار مبتلا به توده تخمدانی را قبل از عمل جراحی به منظور برآورد احتمال خوش خیمی یا بدخیمی آن به نحو دقیقی ارزیابی کند. پزشک باید بتواند تشخیص دهد که آیا می توان توده تخمدان را به امید بهبود خود بخود تحت نظر گیرد یا باید مداخله جراحی انجام دهد. در صورتیکه احتیاج به عمل جراحی باشد، به عهده پزشک است که تشخیص دهد بهترین نحوه عمل جراحی، لاپاروسکوپی یا لاپاراتومی است. جهت اطلاع از جزییات لاپاراسکوپی در زمینه توده های تخمدانی به فصل 46 مراجعه شود.
کانسرهای ارثی تخمدان
فرم های موروثی کانسر تخمدان
به نطر می رسد حدود 5 تا 10 درصد از بیماران مبتلا به کانسر تخمدان یک استعداد موروثی ژنتیک داشته باشند. هر چند این بیماران درصد کوچکی از مبتلایان به کانسر تخمدان را تشکیل می دهند ولی به علت جنبه های بالینی، اجتماعی و اخلاقی این مسئله، تاکید زیادی برروی این این موتاسیون های ژنتیکی شده است.
تا به امروز سه نوع سندرم ارثی کانسر تخمدان شناخته شده است.
* سندرم کانسر پستان - تخمدان که اغلب با ژن BRCA1 در ارتباط است.
* کانسر ارثی کولون غیر پولیپوزی (HNPCC) که به عنوان سندرم کانسر فامیلی و سندرم Lynch II شناخته شده است.
* سندرم کانسر خانوادگی تخمدان وابسته به یک محل خاص که امروزه به ژن BRCA1 منسوب است و به نظر می رسد که زیر گروهی از سندرم کانسر پستان- تخمدان باشد.
خانواده ای مبتلا به سندرم فامیلی کانسر تخمدان وابسته به یک محل خاص، کانسر پستان را در سنین پایین نشان نمی دهند. یک شرح حال دقیق خانودگی جهت تشخیص احتمال استعداد ژنتیکی جهت هر یک از اعضای خانواده باید گرفته شود. سن متوسط بیماران در زمان تشخیص به طور متوسط 10 سال پایین تر از جمعیت عمومی است. تومورها اغلب از نوع سروز هستند و نوع موسینوس و LMP به ندرت به BRCA1 ارتباط دارند.
سندرم کانسر تخمدان - پستان تا 0/085 از تمام کانسرهای تخمدانی ارثی را شامل می شود. درصورتی می توان یک خانواده را مبتلا به سندرم کانسر تخمدان - پستان دانست که حداقل در آن 5 فامیل درجه اول یا دوم مبتلا به کانسر پستان با تخمدان و یا حداقل سه نفر مبتلا به کانسر تخمدان یا پستان با شروع زودرس (قبل از 60سالگی) وجود داشته باشد. در شکل 63 نمونه ای از شجره نامه خانوادگی سندرم کانسر پستان - تخمدان نشان داده شده است. تقریباً تمام کانسرهایی که با ژن BRCA1 ارتباط دارند روی کروموزوم 17q12-21 قرار گرفته اند. آنها که ارتباطی به RCA1 نداشته اغلب به ژن BRCA2 وابسته اند روی کروموزم 13q12-13 قرار گرفته اند. این به خصوص در موارد کانسر پستان در مردها صادق است. با این وجود شیوع کانسر تخمدان در خانواده هایی با ژن BRCA2 به مراتب پایین تر است و خطر کلی در آنان تا سن 70 سالگی کمتر از 10 درصد است.
سندرم HNPCC حدود 15درصد از تمام موارد کانسر ارثی تخمدان را در بر می گیرد. این یک سندرم ژنتیک اتوزوم غالب است که در آن سه یا بیش از سه نفر فامیل درجه اول مبتلا به کانسر کولون (بیش از 0/070 موارد در ابتدای کولون) یا کانسر اندومتر هستند و دو نفر از آنها باید قبل از پنجاه سالگی مبتلا به کانسر شده باشند. علاوه بر این، اعضاء خانواده مبتلا به سندرم HNPCC در معرض خطر سرطان در سایر مناطق دستگاه گوارش، دستگاه ادراری و تخمدان هستند. در گزارشات محدودی که تاکنون در دست است به 3/5 برابر افزایش خطر کانسر تخمدان در اعضای این خانواده ها اشاره
شده است. اخیراً 4 مکان ژنی که همه وابسته به اختلال در ترمیم نقص ساختاری DNA هستند (MMR)، به عنوان مسئول فتوتیپ سندرم HNPCC شناخته شده اند. هتروژن بودن ژنتیک این سندرم به این علت پیشنهاد شده که نقص در هریک از این ژنها می تواند منجر به بروز سندرم HNPCC شود.
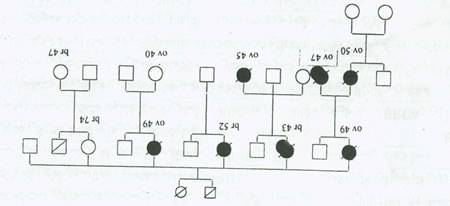
شکل 63:نمونه شجره نامه خانوادگی
ژنتیک مولکولی در کانسر ارثی تخمدان
BRCA1
در اوائل دهه 1990 وجود ژن BRCA1 توسط آنالیز زنجیره ای در مطالعات متعددی به اثبات رسید. سپس ژن مسئول BRCA1 در سال 1994 شرح داده شد. این ژن از 22 اگزون کد کننده تشکیل شده که بیش از صد کیلوباس (Kilobase) از DNA ژنومیک را روی کروموزوم 17q21 اشغال کرده و حدود 5/7 کیلوباس محل کد کننده دارد. این ژن در بیضه و تیموس به مقدار زیاد در تخمدان و پستان به میزان کمتر بیان می شود. عملکرد دقیق ژن BRCA1 هنوز سرکوب کننده تومور جهت آن هستند.
بسیاری از موتاسیون ها که در تمام طول ژن واقع شده اند تاکنون شرح داده شده و اغلب آنها از نوع نامشخص و یا تنها یک تغییر درفرم ساختاری ژن بوده است. موتاسیون نامشخص هنگامی رخ می دهد که یک جابه جایی تنها در یک نوکلئوتید منجربه ایجاد یک کدون متوقف کننده می شود و موتاسیون با تغییر ساختاری وقتی است که این جابه جایی درچند نوکلئوتید رخ داده و منجر به ایجاد یک کدون توقفی می شود و همچنین ثابت شده که فقدان الل ها در محل ویا در اطراف منطقه BRCA1 با از دست رفتن هتروزیگوتی ژن می تواند روی فنوتیپ آن تاثیر بگذارد.
BRCA2
اخیراً ژن BRCA2 نیز به طریقی مشابه با ژن BRCA1 کلونیزه شده است. این ژن از ژن BRC1 بزرگتر بوده و حاوی 26 اگزون کد کننده است و 10/2 کیلوباس مکان کد کننده داشته و روی کروموزوم 13q12-13 واقع شده است. این ژن نیز به مقادیر فراوان در بیضه و تیموس و به مقادیر کمتر در تخمدان و پستان یافت شده است. این 2 ژن در بسیاری از خصوصیات ساختمانی و عملکردی مشترکند. در اینجا نیز می تواند موتاسیون در تمام طول ژن رخ دهد و موتاسیون با تغییر در فرم ساختاری ژن غالب است. ژن BRCA2 نیز از یک نقش سرکوب کننده تومور برخوردار است.
ژن های مسئول ترمیم اشتباهات ساختاری
سندرم HNPCC علت ایجاد یک موتاسیون ارثی در هریک از چهار ژن زیر بوجود می آید: hpms1(کروموزوم hmsh2(2p، (کروموزوم 3q) ویا hpms2(کروموزوم 7p). محصولات این ژن ها در یک مسیر مشترک DNA-MMR دخیل هستند. اکثر بیماران مبتلا به نقصان در ژن hMSH2 یا hMLH1 هستند که به نظر می رسد به عنوان ژن های سرکوب گر تومور فعالیت می کنند. به علاوه، سکانس های ساده تکرار شونده ای در تمام طول ژنوم ها واقع شده است که تغییر در طول این سکانس های تکراری ممکن است منجر به تخریب ساختار پایه DNA شوند و یا قدرت همانندسازی ژنی را که در اینجا ژنهای MMR هستند مختل نماید.این پدیده که به نام ناپایداری ریز ماهواره ای (Micorosattellite) شناخته شده است. مکانیسم دقیق ایجاد تومور به علت این ناپایداری شناخته شده نیست ولی وجود آن همراه با نقصان های ژنی می تواند در ایجاد کانسر وابسته به HNPCC و سایر کانسرهای اسپورادیک ایفای نقش کند.
جنبه های بالینی
آزمایشات ژنتیک
ویژگی های مهم در تست های ژنتیک جنبه های علمی و تکنیکی آن است که شامل: قابل اعتماد بودن آزمایش، ارزش پیشگویی کننده ی آن،تفسیر تست و نهایتاً میزان کارایی آن در پیشگیری از سرطان در بیمارانی است که تست مثبت دارند. به علت تعداد زیاد موتاسیون هایی که تاکنون کشف شده و تعداد بیشتری نیز که در دست بررسی است، ممکن است آزمایشات این ژن ها به لحاظ تکنیکی دشوار باشد و نتایج به آسانی تفسیر نشود. مشکل عمده دیگر در این زمینه، جنبه های اخلاقی، قانونی اجتماعی آن است، چرا که اطلاعات حاصل از آزمایشات ژنی ممکن است مورد سوء استفاده قرار گیرد و باعث ایجاد تبعیض در زمینه استخدام و کاریابی و یا خدمات بیمه گردد. همچنین ممکن است از تست BRCA1 و سایر موتاسیون ها در تشخیص پره ناتال بیماری استفاده شود.
جدول 7:خطر ایجاد سرطان در ارتباط با ژن های BRCa1وBRCA2
|
ریسک نسبی برآورد شده تا سن 70 سالگی
|
ژن پیشنهاد شده
|
نوع کانسر
|
|
85 0/0
مشابه با BRCA1
|
BRCA1
BRCA2
|
کانسر پستان در خانم ها
|
|
0/026-85
<0/010
|
BRCA1
BRCA2
|
کانسر تخمدان
|
|
0/06
|
BRCA1
|
کانسر کولون در خانم ها و اقایان
|
|
0/08
|
BRCA2
|
کانسر پروستات در مردان
|
*ریسک برآورد شده از خانواده هایی به دست آمده که در پروتکل های تحقیقاتی شرکت کرده اند.
ریسک برآورده شده سرطان تخمدان در بیماران مبتلا به موتاسیون BRCA1 از 26 تا 85 درصد تا سن 70 سالگی متغیراست و این میزان برای ژنهای BRCA2 و HNPCC MMR بسیار پایین تر است. ریسک بروز کانسر پستان برای ژنهای BRCA1 و BRCA2 50 تا 85 درصد تخمین زده شده است. در جدول 7 و 8 فهرستی از ریسک نسبی کانسر در ارتباط با این ژنهای مستعد کننده مشاهده می شود. انتخاب صحیح بیماران جهت انجام این تست ها بسیار مهم است. مشاوره ژنتیک ضروری است. از آنجا که در حال حاضر تست های ژنتیکی چه از جنبه اقتصادی و چه آکادمیک بیشتر در دسترس عموم واقع شده، باید پزشک و بیمار در یک همکاری دوجانبه جهت اطمینان از اینکه جنبه های اخلاقی، قانونی و روانشناختی - اجتماعی این کار به خوبی رعایت شده قرار گیرند. سرویس های چند جانبه ای که شامل مشاوره قبل و بعد از تست،غربالگری، درمان وجلسات روانشناختی - اجتماعی است باید درمراکز عمده ارجاع مورد استفاده قرار گیرد وبه صورت گروه های تحقیقاتی کار شود تا اثر بخشی این تست های ژنتیک را به نحو بهینه افزایش دهد.
آنالیزخطر
سابقه خانوادگی به عنوان قابل اعتمادترین عامل پیشگویی کننده جهت خطر سرطان تخمدان شناخته شده است. هرچند بسیاری از زنان، اقوامی مبتلا به کانسر تخمدان دارند، اکثر آنان مبتلا به سندرم ارثی کانسر تخمدان نیستند. همانطور که قبلاً اشاره شد، ریسک برآورد شده جهت کانسر تخمدانی در بیمارانی با نقصان آلل BRCA1 تا سن 70 سالگی 26 تا 85 درصد است.تخمین های بالاتر در مطالعات اولیه برروی خانوده هایی با تعداد زیاد افراد مبتلا گزارش شده است. علاوه برآن، میزان بروز کانسر تخمدان بسته به نوع خاص موتاسیون BRCA1 ممکن است متغیر باشد. سایر عوامل که ریسک نسبی را تحت تأثیر قرار می دهند عبارتند از : محیط، شرایط تولید مثل و یا سایر عوامل اپیدمیولوژیک،
جدول8:ریسک براورده شده ی کانسر در ارتباط با ژن های HNPCC
|
ریسک نسبی براورد شده
|
ژن پیشنهاد شده ی HNPCC
|
نوع کانسر
|
|
خطر نسبی،5/3
|
HMLH1 ،HMSH2 ،HPSH2 ،HPMS2
|
کانسر تخمدان
|
|
68 0/0-75 0/0تا سن 65 سالگی
|
HMLH1 ،HMSH2 ،HPMS1 ،HPMS2
|
کانسر کولون در آقایان و خانمها
|
|
30-39 0/0 تا سن 70 سالگی
|
HMLH1 ،HMSH2 ،HPMS1 ،HPMS2
|
کانسر اندومتر
|
اقوام درجه اول یا دوم فرد مبتلا به یک سندرم کانسر تخمدان - پستان که حامل ژن BRCA1 هستند در معرض خطربالای سرطان تخمدان می باشند. در جمعیت عمومی خطر ایجاد سرطان تخمدان در زنی که یک فامیل درجه اول مبتلا دارد به 5% افزایش می یابد و این ریسک در صورتی که دو نفر فامیل درجه اول مبتلا باشند به 7% بالغ می شود. در مقایسه با خطر عمومی که از1 در 70(1/4%) است این ریسک سه تا پنج برابر شده است. بیمارانی که حامل ژنهای BRCA2 و یا HNPCC هستند و کسانی که خطر سرطان تخمدان در آنان ده درصد و یا تقریباً هفت برابر است، قطعاً به اندازه حاملان ژن BRCA1 در معرض ابتلا نیستند، چرا که ریسک در این مورد می تواند تا 85 درصد بالغ شود ولی بر مبنای مطالعاتی که در جمعیت عمومی تاکنون صورت گرفته احتمالاً پایین از این میزان است.
پی گیری و درمان
غربالگری
پی گیری دردرمان بیماران با استعداد ژنتیکی ابتلا به کانسرتخمدان دشوار است چرا که ریسک نسبی برآورد شده به علت تغییرات متفاوت ژنتیکی و اشتراک آنها با سایر کانسرها (برای مثال کانسرپستان برای BRCA1 و BRCA2 و کانسر کولون برای ژن HINPCC MMR) متغیر می باشد. باید یک برخورد طبقه بندی شده، براساس آخرین اطلاعات در دسترس انتخاب شود تا بهترین نحوه پی گیری در مورد هر فرد یا خانواده به عمل آید. در مطالعات متعددی تکنولوژی غربالگری که در حال حاضر در دسترس است جهت تشخیص سرطان تخمدان چه در جمعیت طبیعی و چه در بیماران پرخطر مورد ارزیابی قرار گرفته است. سونوگرافی واژینال با فلوی داپلر رنگی و شاخص های مورفولوژیک همراه با اندازه گیری سریال سطح CA125 در سرم متدهایی هستند که سودمندی آنها در پی گیری این بیماران به اثبات رسیده است. سونوگرافی واژینال در ردیابی سرطان تخمدان در مراحل اولیه بسیار حساس است، ولی در تشخیص افتراق بین توده های خوش خیم و بدخیم محدودیت داشته و نتیجتاً منحر به موارد بالایی از مثبت کاذب و احتمالاً جراحی بی مورد به خصوص در زنان قبل از یائسگی می شود. CA125 مارکری است که ممکن است در سایر بیماریهای خوش خیم افزایش یابد و یا در مراحل اولیه سرطان تخمدان طبیعی باشد، بنابراین از حساسیت کافی برخوردار نیست. لذا به نظر می رسد، غربالگری جمعیت عمومی با تکنولوژی که در حال حاضر در دسترس است امکان پذیر نیست.
هرچند ممکن است که به علت شیوع نسبتاً پایین بیماری و محدودیت های تکنولوژی در دسترس، غربالگری جمعیت عمومی در حال حاضر با مشکلاتی مواجه باشد،انستیتوی ملی سلامتی و گروه مطالعات ژنتیک سرطان (CGSC) توصیه می کنند که غربالگری در سنین 25 تا 35 سالگی به عنوان بخشی از آزمایشات روتین سالانه یا شش ماهه برای زنانی که حامل موتاسیون ژن BRCA1 هستند شروع شود. با این وجود،سودبخشی این کار کاملاً ثابت شده نیست چون تنها بر مبنای شواهد تجربی توصیه شده است. همچنین CGSC توصیه به غربالگری جهت سایر ارگان ها در این گروه از بیماران می کند. میزان نسبی خطر در بیماران با موتاسیون ژنی BRCA2 چنان پایین است که ممکن است سودبخشی این تست ها را به طرز قابل ملاحظه ای کاهش دهد. در جدول 9 توصیه های رایج جهت غربالگری حاملان، BRCA1 و BRCA2 را ملاحظه می کنیم . غربالگری و جراحی پروفیلاکتیک دربیمارانی با موتاسیون وابسته به HNPCC نیز تنها بر پایه شواهد تجربی است. هرچند نشان داده شده که کولونوسکوپی و آزمایش خون مخفی در مدفوع باعث کاهش میزان بروز و مرگ و میر کانسر کولون خواهد شد. توصیه های رایج جهت غربالگری و درمان این بیماران در جدول 10 فهرست شده است.
اوفورکتومی پروفیلاکتیک
در فرم های ارثی کانسرتخمدان، معمولاً شروع بیماری بین سنین 35 تا 45 سالگری است. بنابراین اوفورکتومی پروفیلاکتیک می تواند در بیمارانی که به دقت انتخاب شده و در معرض خطر بالای ژنتیکی جهت کانسر تخمدان هستند و تنظیم خانواده خود را کامل کرده اند و یا حداقل 35 سال دارند پیشنهاد شود.با این وجود، شواهد مبنی بر سودبخشی برداشتن پروفیلاکتیک تخمدان قطعی نیست و بهترین سن مناسب جهت این کار هنوز مورد توافق همگان قرار نگرفته است. مشکلات حل نشده دیگر در این زمینه عبارتند از:
* تدابیر فیزیولوژیک جهت یائسگی زودرس ناشی از جراحی، به خصوص علائم وازوموتور
* تدابیر روانشناختی - احتماعی جهت مشکلات ناشی از یائسگی زودرس
جدول 9:اهداف درمانی جهت حاملین موتاسیون BRCA1وBRCA2
|
جنبه های قابل توجه
|
کیفیت شواهد
|
توصیه های رایج
|
نوع بیماری(مداخله)
|
|
سودبخشی اثبات شده نیست.
|
(تنها تجربی) III
|
توصیه به معاینه ماهیانه
|
کانسر پستان
معاینه پستان توسط بیمار
|
|
سودبخشی اثبات شده نیست.
|
(تنها تجربی) III
|
معاینه سالانه یاشش ماهه که در سن 25 الی 35 سالگی شروع می شود
|
معاینه پستان توسط پزشک
|
|
خطرات و منافع در زنان زیر 50 سال اثبات شده نیست.
|
(تنها تجربی) III
(معاینات تصادفی در زنان با خطر متوسط در سن 60-50سالگی)I
|
معاینه سالانه با شروع در 35-25سالگی
|
ماموگرافی
|
|
سودبخشی ثابت نشده ،ریسک کانسر تخمدان درحاملین موتاسیون brca2پایین تر است.
|
(تنها تجربی) III
|
آزمایش سالانه یاشش ماهه با شروع در سن 35-25 سال
|
کانسر تخمدان
سونوگرافی واژینال با داپلر
رنگی و سطح CA125
|
|
سود بخشی ثابت نشده است.بسیاری از پزشکان به علت عدم اطمینان از سود بخشی بیمار یابی زودرس را پیشنهاد نمی کنند.
|
(تنها تجربی) III
|
غربالگری شامل معاینه رکتال و سطح آنتی زن ویژه ی پروستات (psa
که سالانه بعد از 50 سالگی اندازه گیری می شود.
|
کانسر پروستات
افزایش بقای مبتلایان کانسر پروستات (تنها در حاملین موتاسیون BRCA1(
|
|
اطلاعات بر پایه ی مطالعات جمعیتی است و میزان قابل اعتماد بودن آن شناخته شده نیست.
|
شواهد از جمعیت با خطر متوسط به دست امده:I
(آزمایشات تصادفی و آزمایش خون مخفی مدفوع)II-2
(مطالعات شاهد-موردی سیگموئیدوسکوپی)
|
توصیه های رایج در جمعیت عمومی :انجام آزمایش خون مخفی مدفوع به طور سالیانه و سیگموئیدوسکوپی انعطاف پذیر هر 3 تا 5 سال که از 50 سالگی آغاز می شود.
|
کانسر کولون
افزایش بقای بیماران مبتلا)
|
*کیفیت شواهد بر پایه شاخص های مورد قبول سرویس پیشگیری آمریکا :Iبالاترین کیفیت (مطالعات تصادفی کنترل شده ی IIکیفیت متوسط (مطالعات توصیفی و غیر تصادفی )؛(3-II،آزمایشات متعدد با و بدون مداخله آزمایشگر )؛IIIپایین ترین کیفیت (گزارشات موردی و شواهد تجربی).
جدول 10:اهداف درمانی و جراحی پیشگیرانه جهت حامیلن موتاسیون وابسته به hinpcc
|
میزان دقت
|
کیفیت شواهد
|
توصیه رایج
|
مداخله یا جراحی
|
|
سودبخشی ثابت نشده است.حساسیت کافی نیست.
|
II-3 (تنها تجربی
|
سالانه،شروع در سنین 35-25
|
سونوگرافی واژینال یا نمونه برداری اندومتر
|
|
کارایی مشخص نیست،خطرات آن به خوبی برآورد نشده است.
|
III (تنها تجربی)
|
اطلاعات جهت توصیه یا منع کردن جراحی کافی نیست.
|
هیسترکتومی و اوفورکتومی
|
* پیشگیری از بیماریهای قلبی عروقی و پوکی استخوان
* درمان جایگزینی هورمون (HRT) به خصوص در کسانی که در معرض خطر افزایش یافته سرطان پستان هستند.
همچنین شواهد مبنی براین است که انطباق پذیری بیماران با درمان طولانی مدت هورمونی رضایت بخش نمی باشد.
اگریک بیمار که در معرض خطر کانسر تخمدان است به هر علتی تحت عمل جراحی شکم و لگن قرار گیرد، باید انجام یک اوفورکتومی پیشگیرانه را جهت وی مد نظر داشت. گزارش شده که برداشتن روتین تخمدانها به صورت الکتیوبعد از سن 40 سالگی حدود 12 تا 14 درصد تمام کانسرهای تخمدان را کاهش خواهد داد، عوارض جراحی ناشی از یک اوفورکتومی اضافی در زمان انجام لاپاراتومی / لاپاروسکوپی به علل دیگر بسیار اندک است. باید به عوارض فیزیولوژیک و روانی - احتماعی ناشی از یائسگی زودرس و HRT توجه شود.
بیمارانی که کاندید انجام جراحی پیشگیرانه می شوند باید تعداد مورد نظر فرزندزایی خود را تکمیل کرده باشند. آنها باید تحت مشاوره ی ژنتیک قرار گیرند و باید به آنها توضیح داده شود که عمل جراحی منجر به یک یائسگی زودرس و در صورت انجام یک هیسترکتومی کامل باعث نازایی برگشت ناپذیر خواهد شد. باید اطلاعات لازم در زمینه HRT به آنها داده شود و همچنین احتمال عدم پذیرش درمان هورمونی در طولانی مدت مد نظر قرار گیرد. باید در مشاوره قبل از عمل به خطرات پوکی استخوان و بیماری قلبی نیز اشاره شود.
در مطالعات توصیفی متعددی کارآیی برداشتن پروفیلاکتیک تخمدان در سندرم ارثی کانسر تخمدان - پستان مورد ارزیابی قرار گرفته است. درموارد کارسینوم اولیه پریتوان که از لحاظ بافت شناسی به کارسینوم تخمدان شباهت دارد درمان باشکست مواجه می شود. این کانسرها در بسیاری از بیماران از 1 تا 27 سال پس از اوفورکتومی پروفیلاکتیت گزارش شده اند. در یک مطالعه 3 نفر از 28 زن _(11%) ودریک مطالعه 6 نفر از 324 نفر (2%) مبتلا شدند. این مطالعات توصیفی پیشنهاد کننده این است که در تعداد قابل ملاحظه ای از بیماران پرخطر، اثرات پروفیلاکتیک خوبی از این عمل بوجود می آید به خصوص اگر احتمال کلی 85% خطر کانسر تخمدان را در طول زندگی آنان در نظر بگیریم. در یک مطالعه مقطعی آینده نگر دیگر، هر چند تعداد بیماران کم بود ولی تفاوت قابل ملاحظه ای از لحاظ آماری در میزان بروز کانسر تخمدان بین گروه اوفورکتومی شده و اوفورکتومی نشده ملاحظه نشد.
توصیه های سایر گروهها و سازمان های تحقیقاتی به قرار زیر است:
* کالج آمریکایی زنان - مامایی در سال 1992: می توان به زنان دارای سابقه خانوادگی سندرم کانسر تخمدان یا تخمدان - پستان که خواهان حفظ قدرت باروری خود نیستند پیشنهاد برداشتن پروفیلاکتیک دو طرفه تخمدان ها را داد. در چنین زنانی باید و جود سندرم خانواگی از طریق آنالیز دقیق شجره نامه باید وجود سندرم خانوادگی از طریق آنالیز دقیق از طریق شجره نامه که توسط متخصص ژنتیک صورت گرفته اثبات شده باشد. به این زنان باید آگاهی داد که برداشتن لوله و تخمدان ها مصونیت 100% ایجاد نمی کند، چراکه در برخی موارد کارسینوم اولیه پریتوان بعد از سالپنگراوفورکتومی دو طرفه نیز گزارش شده است.
* انستیتوی ملی سلامتی «توصیه درمورد کانسر تخمدان» (1994): احتمال وجود یک سندرم ارثی سرطان تخمدان در
یک شجره نامه فامیلی با افزایش تعداد اقوام مبتلا، افزایش تعداد نسل های مبتلا وشروع بیماری در سنین پایین افزایش می یابد. بنابراین، دراین موارد با سنجیدن دقیق خطرات و منافع کار باید برداشتن پیشگیرانه تخمدانها را مد نظر قرار داد. خطرایجاد سرطان تخمدان در زنانی با خانواده های مبتلا به سندرم ارثی کانسر تخمدان آن اندازه بالاست که بتوان به آنها اوفورکتومی پروفیلاکتیک را در سن 35 سالگی یا بعد از تکمیل فرزندزایی توصیه کرد.
* CGSC: شواهد تاکنون جهت توصیه یا برعلیه توصیه انجام اوفورکتومی پروفیلاکتیک به عنوان ابزاری جهت کاهش خطر سرطان تخمدان کافی نبوده است. معهذا، زنانی که دچار موتاسیون BRCA1 هستند باید مطلع شوند که این کار می تواند یک هدف در دسترس جهت آنان باشد. اگر خانمی این روش را انتخاب کرد باید بداند که کانسر ممکن است بعد از عمل نیز رخ دهد. اطلاعات توصیفی تا به امروز جهت یافتن شواهد لازم برای کاهش ریسک کافی نبوده است.
پیشگیری
عوامل پیشگیری کننده که کاملاً به اثبات رسیده اند، همانطور که قبلاً نیز ذکر شده اند، عبارتند: بیش از یک بارداری که تا انتها ادامه یافته باشد، استفاده از قرص های خوراکی جلوگیری از بارداری، شیردادن، بستن لوله ها و هیسترکتومی. با این وجود، نقش این عوامل پیشگیری کننده در درمان زنانی که ریسک شناخته شده ژنتیک جهت کانسر تخمدان دارند هنوز مورد بررسی قرار نگرفته است. بنابراین جهت تامین میزان کارآیی آنان به عنوان عوامل پیشگیری کننده در مراقبت از این بیماران پرخطر، قبل از اینکه به عنوان روش های موثر مورد قبول قرار گیرند، احتیاج به مطالعات اپیدمیولوژیک وجود دارد.
منبع:
/ج