پس حدود یک سال بررسی سرانجام سازمان غذا و داروی آمریکا (FDA) مجوز ورود به بازار ایمپلنت کنترل کننده قند خون موسوم به «continuous glucose-monitor» (به اختصار CGM) را صادر کرد.
ایمپلنت مذکور می تواند به مدت بیش از سه ماه در زیر پوست کاربر قرار گرفته و در فواصل زمانی کوتاه میزان گلوکوز قند خون او را از طریق یک اپلیکیشن موبایل به نمایش بگذارد. این یک دستاورد بزرگ به حساب می آید. چرا که نمونه های پیشین که روی پوست قرار می گرفتند تنها قادر به ارائه سرویس تا 10 روز بودند. این نخستین بار است که یک CGM ایمپلنتی مجوز FDA را دریافت می کند.
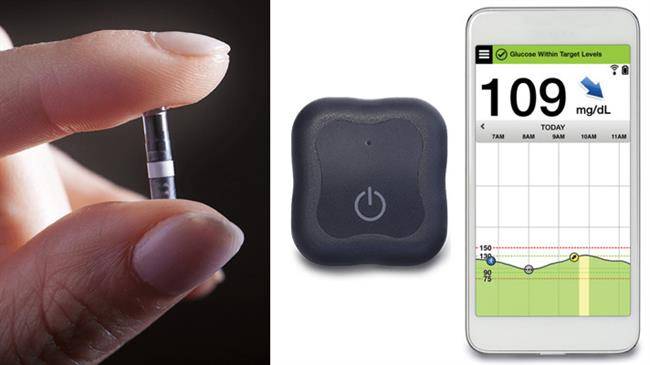
نکته مهم آن است که سنسور مورد بحث می بایست تنها از طریق مراکز بهداشتی معتبر در بدن بیمار وارد و یا از آن خارج شود و این طور نیست که افراد عادی بتوانند خودسرانه این کار را انجام دهند. شیوه کار سنسور نیز نسبتاً ساده است. در سطح بخش حسگر آن ترکیبی فلورسنت وجود دارد که در تماس با گلوکوز تولید نور می نماید. از روی شدت نور تولیدی می توان سطح قند موجود در خون فرد را تشخیص داد. نتیجه اندازه گیری ها هر 5 دقیقه به موبایل کاربر ارسال می شود.
ایمپلنت کنترل کننده قند خون که با نام تجاری «Eversense» شناخته می شود، طوری طراحی شده تا در بدن افراد ایجاد حساسیتی نکند. طبق بررسی FDA، تنها کمتر از یک درصد احتمال آن وجود دارد که بدن بیمار به این ایمپلنت واکنش منفی نشان دهد.

البته ذکر این نکته نیز ضروری به نظر می رسد که در گزارش سازمان و غذا و داروی آمریکا اشاره ای به میزان دقت Eversense در مقایسه با دیگر متدهای رایج سنجش قند خون نشده است، بنابراین برای تعیین این پارامتر نیاز است تا بررسی های مجزایی صورت بگیرد.