پستان
The Breast
امروزه سرطان پستان به احتمال زیاد شایعترین بیماری ترس آور زنان در آمریکاست و انسیدانس آن رو به رشد است.در سال 1997 حدود 180000 مورد جدید و 44000مرگ و میر گزارش شده است.این سرطان علت اصلی مرگ ناشی از سرطان در زنان 45-30 ساله بوده 30% سرطانهای زنان و 17% مرگ و میر کلی ناشی از سرطان ها را تشکیل می دهد. سرانجام اخبارخوب درباره سرطان پستان را نشان داد.
متخصصین زنان و زایمان عموماً پزشک مراقبتهای اولیه بسیاری از زنان 20 تا 65 ساله هستند.این پزشکان نقش کلیدی در ردیابی ناهنجاریهای پستان و همچنین در زمینه آموزش غربالگری و مشاوره تمام موارد خوش خیم و بدخیم بازی می کنند. انجمن متخصصین زنان و مامائی آمریکا دوره ای را جهت دستیاران از نظر بررسی های شناختی،رفتاری و تکنیکی مراقبتهای پستان برگزار نموده است.
این مقاله در مورد غربالگری،وضعیت های شایع خوش خیم وبدخیم،و نقش متخصص زنان و مامائی بعنوان یک کلینیسین بحث می کند.
ردیابی و تشخیص
شرح حال و معاینه
یک تاریخچه کامل درآغاز بسیارحیاتی بوده و باید در راستای عوامل خطرساز برای سرطان پستان باشد(جدول 1).شناخته شده ترین عوامل خطر اپیدمیولوژیک شامل سابقه سرطان در پستان دیگر یا منسوبین درجه 1 است.
جدول 1:فاکتورهای خطر برای کانسر پستان
|
فاکتور
|
خطر نسبی
|
|
سابقه خانوادگی سرطان پستان
بستگان درجه اول
بستگان درجه اول در زمان پیش از یائسگی بستگان درجه اول بعد از یائسگی
بستگان درجه اول پیش از یائسگی
(کانسر دو طرفه پستان)
بستگان درجه اول بعد از یائسگی
تاریخچه قاعدگی (سن بر حسب سال)
منارک پیش از 12 سال
منارک بعد از 17 سال
یائسگی پیش از 45 سال
یائسگی در سنین 54تا45 سال
یائسگی بعد از سن 55 سال
یائسگی بعد از سن 55 سال
با>40سال قاعدگی
افووفورکتومی پیش از سن 35 سالگی
چرخه های قاعدگی بدون تخمک گذاری
تاریخچه حاملگی
حاملگی ترم پیش از سن 20 سال
نخستین حاملگی ترم در سن 34 تا20 سال
نخستین حاملگی ترم پس از سن 35 سالگی
خانم نولی پار
بیماریهای غیر مهاجم پستان
هیپرپلازی لبولار غیر تیپیک
کارسینوم لبولار درجا
سایر نئوپلاسم ها
کانسر پستان طرف مقابل
کانسر غده بزاقی ماژور
کانسر رحم
|
8/1
3
5/1
9
4/5-4
4/3-7/1
3/0
7/0-5/0
1
5/1
5-5/2
4/0
4-2
4/0
1
4-5/1
4-3/1
4
2-7
10-2
4
2
|
یک سابقه خانوادگی سرطان پستان خطر آنرا به 3-2 برابر و حتی تا 9 برابر در مورد سرطانهای دو طرفه در سنین زیر یائسگی اقوام درجه یک در زنانی که زایمان نداشته اند،کسانی که سن یائسگی آنها در 66 سالگی آغاز می شود و اولین بارداریشان پس از 35 سالگی بوده است. احتمال سرطان پستان به دو تا سه برابر افزایش می یابد.بنظر می رسد سن، مهمترین عامل خطرساز باشد زیرا خطر سرطان و پستان با افزایش طول عمر افزایش می یابد.بهرحال وقتی عوامل خطر شناسائی و بطور جداگانه یا همراه بررسی شوند فقط 21% خطر سرطان پستان را در میان زنان 55 تا 84 سال توجیه می کنند؛ بنابراین از دیدگاه پزشکان، تمام زنان بویژه در سنین بیش از 35 سال درخطراین سرطان قرار دارند. سرطان پستان در آمریکا در میان زنان دارای رتبه اجتماعی بالاتر شایعتر از مراتب اجتماعی پایین تر است. در گذشته اعتقاد بر این بود که سفیدپوستان بیش از سیاهپوستان در معرض خطراند.ولی این مسئله فقط در سن بالای 45 سال صدق می کند. مرگ و میر در مناطق شهری بیشتر و در نواحی شمال شرقی بالاتر از جنوب شرقی است.
تعدادی ازعوامل باروری همراه با افزایش خطر سرطان پستان بوده اند. مثلاً سن در هنگام تولد اولین فرزند.هرچه مادر در این زمان جوانتر باشد خطر این سرطان کاهش می یابد،ولی هنوز علت این همراهی شناسائی نشده است.بعلاوه، در چندین پژوهش، ارتباط کاهش خطر این سرطان با شیردهی گزارش شده است. علت این امر تا حدودی آن است که شیردهی همراه بارداری به پایان رسیده و بنظر می رسد تعداد و زمان بارداری نقش حفاظتی در آن دارد.
تاثیر یائسگی دیررس بر سرطان پستان بررسی و ثابت شده است.اگر یائسگی طبیعی در سن 55 سالگی یا بیشتر رخ می دهد.احتمال ایجاد سرطان پستان بیشتر و در صورت برداشتن دو طرفه تخمدانها پیش از یائسگی طبیعی این احتمال کمتر خواهد شد.درصورتیکه تخمدان ها پیش از 35 سالگی خارج شوند،70% کاهش در ریسک سرطان پستان روی می دهد.این داده ها بیانگر این نکته اند که طول سالهای باروری یک عامل همراه این سرطان است.باید توجه داشت که بیشتر توده ها توسط خود بیمار کشف می شوند.اگربیمار توده ای را پیدا کند نکات مهم شرح حال عبارت خواهند بود از:طول زمان،همراهی درد در ارتباط با قاعدگی و احتمال ایجاد فرورفتگی پوست. درد در تغییرات کیستیک بیشترین و در کارسینوم کمترین شیوع را دارد. اگر در خانم یائسه درد ثابت و یکطرفه ای وجود داشته باشد،باید بیشتر مشکوک شد. یک ضخامت دردناک قبل از قاعدگی به احتمال بیشتر engorgement خوش خیم یا تغییرات فیبروکیستیک است تا بیماری بدخیم.با فرو رفتن پوست احتمال کارسینوما بیشترمی شود.این فرو رفتگی نتیجه کوتاه شدن لیگامان کوپراست.ترشح نوک پستان را باید بررسی کرد. ترشحات بدخیم بیشتر یکطرفه،خونی و خودبخود هستند.در بیماران یائسه باید این ترشح را به دقت بررسی کرد.یک شرح حال مفصل از جراحی قبلی،عفونت و ضربه به پستانها یا ترشح نابجای شیر لازم است.
پرسشهای بی شماری درباره زمان و چگونگی انجام معاینه پستان وجود دارد. بهترین زمان پس ازاتمام قاعدگی و قبل از تخمک گذاری است.این زمان به صحت بیشتر معاینه و خودداری از معاینه یک پستان engorged و دردناک کمک می کند. در حالت ایستاده پستان باید از نظر اختلالات پیش سرطانی از جمله: فرورفتگی،انحراف یا نوک پستان فرورفته همچنین اختلالات پوستی مورد مشاهده قرار گیرد اینکار باید در حالتی که دستهای بیمار از دو طرف آویخته است وسپس با بالا بردن بازوها و سرانجام با فشار دستان به کمر به منظورانقباض عضلات پکتورال انجام شود.(شکل1).اختلالات پوستی که نشانه مشکلات عمیق ترند شامل ورم، خال،یا واکنشهای شبه اگزمایی می باشند. اگر پوسته هی قرمز دراطراف آرئول دیده شود باید به بیماری پاژه مشکوک شد.
در معاینه بیشترباید به نواحی فوق ترقوه زیر بغل دقت کرد.لمس انگشتی اززیر عضلات پکتورال در خارج بطرف آگزیلا انجام می شود.حتی در موارد منفی بودن معاینه بالینی زیر بغل در60% موارد عقده های لنفاوی متاستاتیک در بیماران مبتلا به سرطان پستان وجود دارد.معهذا زیر بغل باید به دقت معاینه شود.
مرحله دوم معاینه پستان در حالیکه بیمار به صورت طاقباز خوابیده است انجام می شود. ابتدا معاینه کننده مشاهده کاملی از پستان، دیواره قفسه سینه و زیر بغل بعمل می آورد.تشویق بیماران به فراگیری و انجام خودآزمایی پستان بسیار مهم است. اگر پزشک شخصاً اینکار را بکند بیماران بهتر عمل می کنند.
بروشورها مفیدند ولی تأثیر صحبت پزشک در مورد خود آزمائی پستان را ندارند.در طی آموزش بیمار،پزشکان فرصت معاینه اختصاصی و توضیح یافته های طبیعی و غیرطبیعی را برای بیمار پیدا می کنند. سپس لمس با بهره گیری از انگشتان نشانه و میانی با فشارهای مختلف و با کف یا نوک انگشتان بعمل می آید.یک معاینه کامل شامل تمام پستان و قفسه سینه است.درآغاز سطحی و بررسی پوست،سپس بطور متوسط داخل استرومای پستان و زیر پوست و سرانجام روش Triple Touch در عمق برروی دیواره قفسه سینه انجام می گیرد.تمام پستان باید بطور سیستماتیک معاینه شود.معاینه را می توان بصورت حرکت عقربه های ساعت یا بصورت نواری درطول کمانهائی مشخص انجام داد. Strip wise معاینه ناحیه زیر نیپل و آرئول و آگزیلا بسیار مهم است.نیمی از سرطانهای پستان در
یک چهارم فوقانی خارجی آن، 18% در زیر نیپل و 15% در یک چهارم فوقانی داخلی روی می دهند.
اگردرمعاینه ضایعه ای پیدا نشد اثبات یافته منفی بسیارمهم بوده و غربالگر و برنامه ریزی برای پیگیری مطرح می شود. خلاصه یافته های منفی در بیمار را می توان بصورت زیرارائه داد:بدون توده قابل لمس،بدون فرورفتگی، بدون ترشح نوک پستان و نیافتن لنفادنوپاتی در حالت نشسته و خوابیده به پشت.تاریخ آخرین ماموگرافی باید ذکرشود.عوامل خطر ساز مانند استفاده از هورمونها یادداشت شده و هرگز ضد بارداریهای خوراکی را نباید پیش از انجام معاینه سالیانه به صورت مجدد تجویز شوند.همینطور باید از تجویز و نسخه نویسی مجدد هورمونها پیش از معاینه پستان و ماموگرافی خودداری کرد.این روشها برای محافظت بیمار و پزشک از عدم شناسایی به موقع سرطان پستان لازم اند،بویژه که 75% شکایات موفق دراین زمینه از پزشکان مراقبت بهداشتی اولیه زنان و مامائی صورت گرفته است.مهم قطعی و دقیق بودن چارت طبی است زیرا تقریباً1/3 موارد نتیجه نقص مستندات پرونده هاست.
توده غالب
درطی معاینه پستان کشف ضایعه حکم می کند تا سرطانی یا غیر سرطانی بودن آن را تشخیص دهیم.درصورت لمس توده،باید تعین کرد که توده مجزا و سه بعدی است یا ضخامتی است که معمولاً در تغییرات فیبروکیستیک به آن بر می خوریم. توده مجزا را معمولاً به عنوان توده غالب (Dominant mass) می شناسم.هرگاه توده ای شناسایی شد،باید تشخیص برنامه ریزی و سرطان رد شود.گام اول اندازه گیری ضایعه است که گاهی این کار را می توان با فشارتوده روی دنده زیر آن انجام داد.گام بعدی تعیین کیستیک یا توپر بودن توده است.پس از تمیزکردن پستان با پد الکلی یک سوزن 23 به سرنگ 10cc متصل کرده،درحالیکه با دست دیگر توده را ثابت نموده ایم،مستقیماً سوزن را بداخل آن فرو می بریم.با عبور سوزن از پوست، فشار منفی ایجاد می کنیم.اگر توده کیستیک باشد،مایع بطور کامل کشیده شده و توده باید کاملاً ناپدید شود.سپس ساکشن قطع و سوزن از بافت پستان خارجی می شود. اگر مایع،سروز یا غیر خونی باشد دور ریخته می شود وبه بیمار توصیه می شود 6-4 هفته بعد برای معاینه مجدد مراجعه کند.
دریک ضایعه غیر کیستیک، FNA( آسپیراسیون با سوزن ظریف) انجام می شود.هنگامی که ضایعه جامد است،با استفاده از همان روشی که قبلاً شرح داده شد،سوزن در توده وارد شده،سپس هشت تا ده بار همگام با ساکشن کامل به جلو و عقب حرکت داده می شود.پس از آن سرنگ جدا شده،فشارطبیعی می شود و سوزن خارج می گردد.سپس،اسمیر برای آزمایش سلول شناسی آماده می گردد . معمولاً برای نمونه بردای کافی و افزایش تجمع سلولی از هر توده،دو با سه نمونه جداگانه تهیه می شود. فرآورده سلولی می تواند مانند تست پاپانیکولائو یک لایه ای تهیه شود و یا می توان سرنگ را در لوله ای حاوی Cytofixtive (محلول فیکس کننده سلولی) شستشو داد تا یک بلوک سلولی برای بررسی سلولی سیتولوژی بدست آید(شکل 2).تعداد نمونه گیریهای موفق بوسیله FNA از 50 تا 87% متغیر می باشد.

پزشکان نباید روی یافته های منفی FNA تکیه کنند بررسی مورد قبول و استاندارد، برداشتن تمام توده های جامد سه بعدی است مگرآنکه بتوان بوسیله FNA قطعاً به تشخیص خوش خیمی رسید.یک بیوپسی باز همچنین برای یک ضایعه کیستیک که پس از آسپیراسیون مایع بطورکامل ناپدید نشده لازم است.اگرمایع کیست خونی باشد،یا کیست پس از دو یا سه بار تخلیه عود کند یا در یک توده غالب بعنوان فیبروآدونوم تشخیص داده نشده باشد.یا بیمار مبتلا به ترشحات خونی از نوک پستان،زخم پستان یا ورم پوست مشکوک به کارسینوم باشد، انجام بیوپسی باز (open biopsy) لازم به نظر می رسد.مقصود از انجام PNA تعیین وجود یا عدم وجود بدخیمی و آماده سازی فوری بیماربرای درمان سرطان در موارد لزوم است.اگرضایعه کیستیک باشد FNA هم تشخیص و هم درمانی است و اضطراب بیمار را بر طرف می کند. اگر توده قابل لمس یک توده مجزای غالب نباشد باید پزشک بین تغییرات فیبروکیستیک و پارانشیم غیر قرینه پستان که باید بیوپسی شود افتراق دهد.دربیماران مشرف به آغاز قاعدگی باید پس از اتمام آن مجدداً معاینه انجام داد.حساسیت،ویژگی،ارزش پیشگوئی مثبت و ارزش پیشگوئی منفی FNA بترتیب 82%، 97%، 95% و 96% است.میزان مثبت کاذب معمولاً 1/2% و کاذب منفی 7/7% است.تشخیص افتراقی ضایعه ای توپر عبارتند از:
*اختلالات التهابی،ماستیت حاد،ماستیت پلاسماسل، آبسه زیرآرئول و نکروز چربی.
* تومورهای خوش خیم،تغییرات فیبروکیستیک،آدنوم های شیری،پاپیلوم اینتراداکتال،آدنوم نیپل (نوک پستان) و تومور سلول گرانولر.
ماموگرافی (Mammography)
برای سالها درمورد بهترین سن شروع و بهترین فواصل غربالگری ماموگرافی بحث و جدل بود.درمارس 1997 انجمن سرطان آمریکا ماموگرافی سالانه را درتمام زنان سالم بدون علامت از سن 40 سالگی برقرار کرد(جدول2). این روش بر اساس کارگاه آموزشی این انجمن که اطلاعات قدیمی و جدید این موضوع مورد اختلاف را بررسی کرد،توصیه شد.8 پژوهش تصادفی بالینی در مورد غربالگری سرطان پستان انجام شد.آخرین بررسی این پژوهش نشانگر 18% کاهش مرگ و میر با 95%=Confidence Interval) CI) ، 0/95-0/71دربین زنان غربال شده 40 تا 49 ساله می باشد.7 تحقیق که برپایه جمعیت برنامه ریزی شده بود،26% کاهش مرگ ومیررا درگروه های سنی همگن نشان داد.
دو پژوهش درسوئد بیانگرکاهش مهم آمار مرگ و میردربین زنان 40 تا 49 ساله بودند.پژوهش گوتنبرگ که 12 سال پیگیری داشت،44% کاهش مرگ و میررا نشان داد. پژوهش مالمو 36% کاهش مرگ ومیر را نشان داد.برحسب نتایج این پژوهش کاهش نسبی مرگ و میر درزنان 49-40 ساله نسبت به زنان 50 ساله یا مسن تر بیشتر دیده می شود.مشاهدات مذکوراین پرسش را در اذهان برانگیخته که آیا می توان فوائد این کاررا به زنانی که در دهه 40 مورد پژوهش قرار گرفته و پس از 50 سالگی بعنوان بیماربه سرطان پستان تشخیص داده شدند،تعمیم داد؟ بنظر می رسد که بروز تأخیری کاهش نسبی مرگ و میرکه در زنان جوانتر در مقایسه با مسن ترها دیده شده را می توان اینگونه توضیح داد:
1- کمی تعداد زنان 40تا50 ساله در این بررسی.
2-بخش بزرگتر تشخیص داکتال کارسینوما (Ductal carcinoma in situ) در گروه دعوت شده به غربالگری.
3- شیوع و مرگ ومیر پائین تر در زنانی که در سنین 40 تا 50 سال هستند.
جدول 2: معیارهای راهنمای غربالگری سرطان پستان 1997، انجمن کانسر آمریکا
|
*معاینه ماهیانه پستان توسط خود زنان 20 سال و بیشتر .
*ماموگرام سالیانه برای زنان سنین40 سال یا بیشتر .
*معاینه بالینی پستان برای سنین 40-20سال هر3 سال و سالیانه برای زنان مسن تراز 40سال .
|
مشاهده اینکه دراغلب بررسی ها، فواصل بررسی طولانی تر از یکسال در ردیابی تومورهای مهاجم تر در مراحل پائین تر تأثیرکمتری دارند.نتایج آزمون های غیر انتخابی و برنامه های بزرگ اجتماعی شواهدی دال برحمایت از معیارهای راهنمای ACS است. بررسی ها نشان دادند که بخش بزرگتری از سرطانهای پستان در زنان جوانتر سریعتر از زنان مسن رشد می کنند.بنابراین برای حداکثرسودمندی غربالگری زنانی 40 تا 49 ساله مهم است که فواصل غربالگری در زنان کمتر و بیشتراز 50 سال همسان باشد(غربالگری سالیانه).باید از داده های پیشین دریافت که مقایسه زنان 49 تا 40 سال با تمام زنان بالای 50 سال کاری تصنعی است.
یک سیستم استاندارد گزارش BI-RADS) Breast Imaging Reporting and Data System) توسط کالج آمریکائی رادیولوژیست ها (ACR) در سال 1995 پایه ریزی شد(جدول 3).درگذشته همسان نبودن ترمینولوژی و گزارشات ماموگرافی اغلب سبب مخدوش شدن درک بدخیم بودن توده می شد. BI- RADS باعث همسانی توضیح یافته های ماموگرافیک شد.معاینه یکی از 5 مرحله اساسی بررسی می باشد و هریک ازاین مراحل یک نوع برخورد ویژه را می طلبد.
ماموگرافی باید قبل ازهربیوپسی باز انجام شود.ماموگرام شاید بتواند حدود ضایعه قابل لمس را بهترنشان داده وسایرضایعات پستان مبتلا یا پستان دیگر را که نیاز به درمان دارند،مشخص نماید.غربالگری با فیلم ماموگرافی درهمه جا بعنوان تست غربالگری رادیولوژیک سرطان پستان پذیرفته شده است.درماموگرافی تشخیص، اینکاردربیمارانی که دچارعلائم پستان، توده های قابل لمس یا تاریخچه مشخصی از ماموگرافیهای غیرطبیعی هستند انجام می گیرد.دراین گونه موارد،رادیولژیست در معاینه حاضر بوده و می تواند در صورت لزوم دستورفیلم های اضافی را بدهد.در مقابل ماموگرافی غربالگری در بیماران بدون نشانه و توسط یک تکنسین بدون لزوم حضور رادیولوژیست انجام می گیرد. رادیولوژیست بعداً فیلم ها را می خواند، بنابراین هزینه ها کاهش می یابد. آنومالیهای ماموگرافیک به سه گروه تقسیم می شوند:کدورت ها،میکروکلسیفیکاسیون ها و غیر قرینگی پارانشیمی:یافته های زودرس سرطان پستان در ماموگرافی عبارتند از :
* توده توموری،معمولاً با حدود نامنظم یا Spiculated.
* کلسیفیکاسیون های کوچک گروهی( تجمعی) با یا بدون توده.
* کدورت های نامتقارن بد شکل پستان به ویژه اگر در فاصله دو بار آزمایش ایجاد شده باشند.
* تخریب سازمان یافته پستان بوسیله تومور.
با کدورتهای غیر قابل لمس در ماموگرافی بهمان شیوه توده های قابل لمس برخورد می شود.
کدورتها می تواند جامد یا مایع،تازه یا کهنه باشند.آزمایش اولتراسونیک می تواند کیست ساده را مشخص کند که معمولاً به صورت تنها دیده می شوند،مگرآنکه یک ساختار مختلط داشته باشند.فیلم های پیشین می توانند درافتراق یافته های تازه و قدیمی و بزرگ شدن توده های قدیمی کمک کنند.
میکروکلسیفیکاسیونها می توانند منتشر با مجتمع،ظریف یا خشن و تازه یا قدیمی باشند.فیلم های پیشین و بزرگنمائی اضافی می توانند کمک کننده باشند. کلسیفیکاسیونهای خوش خیم،مشخصاً بطور طبیعی منتشر هستند تا مجتمع. کلسیفیکاسیونهای خوش خیم ترشحی، ضخیم،صاف یا حلقه مانند هستند. کلسیفیکاسیونهای خشن که در داخل یک کدورت مدورمحدود شده اند،معمولاً فیبروآدنوما هستند.انواع بسیار دیگری از کلسیفیکاسیونهای خوش خیم وجود دارند؛ از جمله کلسیفیکاسیونهای حلقه ای پوست، کلسیفیکاسیونهای تیپیک و خطی موازی عروق و ظاهرلایه ای Milk of Catcium درکیست های کوچک.
احتمالاً شایعترین یافته رادیولوژیک غیر طبیعی،غیرقرینگی پارنشیم است.فیلم های قبلی پستان برای مقایسه اهمیت دارند و باید دستورانجام فیلمهای کمپرسیونی را داد .توصیه نهایی انجام یا عدم انجام بیوپسی پستان باید توسط یک رادیولژیست ماهر انجام شود. امکان مخفی شدن بعضی انواع سرطانها (مثلاً لبولر)در یک پستان با پارانشیم غیرقرینه وجود دارد.
جدول 3. گروه های حاصل از ارزیابی نهایی ماموگرافی
|
گروه
|
ارزیابی
|
توصیف
|
توصیه
|
|
1
|
منفی
|
هیچ نکته ای وجود ندارد
|
غربالگری روتین
|
|
2
|
یافته خوش خیم
|
ماموگرام منفی است اما تفسیر گر تمایل به توصیف یک یافته دارد.
|
غربالگری روتین
|
|
3
|
احتمالاً یافته خوش خیم
|
احتمال بسیار بالای خوش خیمی
|
پیگیری کوتاه مدت برای اثبات پایداری ضایعه
|
|
4
|
اختلال مشکوک
|
علامت مشخصه ای ندارد ولی شک به بدخیمی وجود دارد.
|
باید بیوپسی را مدنظر داشت.
|
|
5
|
احتمال بدخیمی
|
احتمال بالای بدخیمی
|
روش مناسب باید اعمال شود.
|
امروزه پزشکان بیشترازالگوریتم هایی که برای بررسی یافته های غیرعادی پستان پایه گذاری شده اند سود می برند.
بیوپسی پستان
به جراحانی که با درمان جدید سرطان آشنایی دارند،توصیه می شود تا درصورت ضرورت اقدام به انجام بیوپسی بازنمایند. کالج آمریکایی زنان و زایمان توصیه های قبلی را درمورد اینکه هرمتخصص زنان و زایمان می تواند بیوپسی بازرا انجام دهد مردود دانسته است.
هنگامی که یک ضایعه بصورت توده معرفی و اندازه گیری می شود.این نکته باید در نظر گرفته شود که ضایعه خوش خیم است یا بدخیم.درمرحله اول FNA انجام شود بسیاری ازکیست ها تحت فشار بالا بوده و در لمس ویژگی های توده های جامد (Solid) را دارند.اگرتوده غالب واقعاً بصورت جامد باشد،باید بیوپسی انجام شود. سایراندیکاسیون های بیوپسی بشرح زیر است:
* اریتم و ادم واضح که مطرح کننده کارسینوم التهابی است.
* ترشح یکطرفه در یک بیمار یائسه.
* ترشحات سروسنگوینوس یا خونی نوک پستان.
* دلمه مداوم نوک پستان معمولاً با حاشیه نامشخص همراه با یافته های مشکوک ماموگرافی.
برای اطمینان بهتر است بیوپسی هر چه سریعترانجام گیرد بیوپسی را می توان در بسیاری از بیماران بصورت سرپایی با بی حسی موضعی انجام داد.
بیوپسی باید در اطاق عمل که در آن پرسنل آگاه و آشنا با تکنیک های بیوپسی حضور دارند انجام شود.انتخاب طرح و نوع برش (incision) اهمیت دارد.درمواردی که توده در محلی با فاصله از کمپلکس nipple - areola قرار دارد، اکسیزیون لوکال وسیع ممکن است عملی نباشد.برش باید با دقت انتخاب شود(شکل 3).برش دورآرئول (Circumareolar incision) علی رغم اینکه ظاهربسیار خوبی ازنظرزیبایی دارد ولی معمولاً برش قابل قبولی نیست؛بجزدرموارد نادرکه ضایعه دقیقاً زیرکمپلکس آرئولا واقع است. محل برش درهردو وضعیت نشسته و ایستاده مشخص شده و سپس بیمار آماده می شود.معمولاً ازبی حسی موضعی استفاده می شود.ازکوتر یا بخیه های لیگارتوری ظریف برای کنترل خونریزی در طول پروسه عمل استفاده می شود.در بسیاری ازموارد،یک بیوپسی اکسیزیونال انجام شده و کل ضایعه خارج می شود.در مواردی که ضایعه بزرگی وجود دارد و جراحی های اضافه برای آن پیش بینی می شود،یک بیوپسی انسیزیونال برای بررسی توصیه می گردد.
هنگامی که یک ضایعه خارج می شود بخیه های ظریف برای کنترل خونریزی ارجحیت دارند.نقاط خونریزی دهنده دربافت سفت پستان با کوترکردن بهترکنترل می شوند ولی این روش در مهارخونریزی از رگ های بزرگ قابل اعتماد نیست.پس ازاین مراحل باید با حداقل بخیه ها و استفاده از الیاف و وسایل ظریف دراین پروسه بافت پستان بصورت
شل (Loosely) بازسازی شود.اگرزخم خشک باشد،گذاشتن درن ضروری نیست. سپس پوست با بخیه های ساب کوتیکولارو fine vertical mattress بسته می شود.دراین عمل قراردادن یک پانسمان فشاری که با بانداژالاستیک پشتیبانی می شود (مانند Ace bandage) بسیار پر اهمیت است.این پانسمان باید تا 48 ساعت در محل باقی بماند.بی حرکت کردن و استفاده از فشارباعث کاهش واضح تورم و تشکیل هماتوم در محل می شود.پس از 5-7 روز، بخیه ها برداشته می شوند.در صورتی که ضایعه بدخیم باشد،درمان های لازم باید جایگزین شوند.
از آنجایی که بیوپسی به صورت بخشی از درمان درآمده است،لذا باید با دقت و وسواس زیادی انجام شود.داشتن دانش و مهارت کافی برای انجام بیوپسی بسیار مهم می باشد ولی متأسفانه،جراحانی وجود دارند که از ملزومات درمان محافظه کارانه و شروط آن اطلاعی ندارند.انتخاب یک برش نامناسب،تورم و هماتوم واضح بعد از بیوپسی می تواند باعث غیرممکن شدن اکسزیون لوکال گسترده (wide local excision) گردیده و به یک ماستکتومی غیرضروری ختم گردد.پاتولوژیست مسئولیت ویژه ای را دراین امر برعهده دارند.مشخص کردن دقیق حاشیه اکسیزیون از جمله این مسئولیت هاست.جهت تعیین و آنالیزاستروژن و پروژسترون،بافت کافی باید برداشته شود.دیدن و وجود حاشیه سالم (Clear) دربیوپسی بسیارمهم است لذا در مواردی که ضایعه کاملاً خارج نشده است، اکسیزیون مجدد یا ماستکتومی باید انجام گیرد.
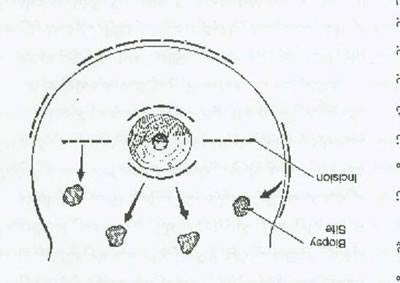
شکل 3. محل های برش بیوپسی پستان جهت بدست آوردن نتیجه مناسب از نظر زیبایی.
بیوپسی های لوکالیزاسیون سوزنی (needle localization) بعنوان یک روش جراحی رو به گسترش است. تعدادی ازضایعات وجود دارند که بطور کلینیکی قابل تشخیص نمی باشند.تعیین ضایعاتی که قابل لمس نیستند،با وارد کردن یک سوزن که معمولاً دارای یک قلاب سیمی درونی است و هماهنگی بین آناتومی توپوگرافیک پستان و تصاویرماموگرافی قابل انجام است.پروسه مذکوربه این صورت است که جراح با وارد کردن یک سوزن را تا هدف هدایت کند.برای تایید اینکه ضایعه در نمونه گرفته شده قرار دارد یا نه،یک رادیوگرافی ساده بعد از خارج نمودن ضایعه و سوزن گرفته می شود.
با پیشرفت های ایجاد شده در تکنولوژی ماموگرافی بوسیله CNB) Core Needle Biopsy) استریو تاکتیک تشخیص های هیستولوژیک (بافتی) امکان پذیر شده و این فن آوری باعث حذف نیاز به جراحی جهت انجام بیوپسی گردیده است.گزارشات زیادی در متون پزشکی تأئید کننده حساسیت و ویژگی CNB هدایت شده به روش استریوتاکتیک می باشد(حساسیت 71% تا 100% و ویژگی 85 تا 100%).دراین روش از وسایل رادیوگرافی پیچیده و تفنگ بیوپسی خودکار جهت بریدن مرکز بافت استفاده می شود.با استفاده از روش CNB امکان برداشتن نمونه های مختلف از توده های غیرقابل لمس یا نواحی مشکوک درون پستان بدون نیاز به جراحی وجود دارد.از برتری های این روش قیمت کمتر است که بدلیل حذف هزینه های اتاق عمل می باشد.با این روش اسکار کوچکی وجود خواهد داشت و اثر پایداری در مطالعات ماموگرافیک بعدی ندارد.
تفاوت هایی که درنتایج چاپ شده CNB وجود دارد نتیجه عوامل مختلفی از جمله موارد زیراست:تعاریف پایه و متدولوژی، انتخاب بیمار،اندازه سوزن بیوپسی و تعداد نمونه ایی که بدست می آید.بطورکلی وقتی که سوزن شماره 14 بجای سوزن های کوچکتراستفاده می شود نتایج بهتری گزارش می گردد.بررسی های اخیرنشان می دهد که برداشتن پنج نمونه بوسیله سوزن 14 دقتی در حدود 99% برای تشخیص توده دارد.جهت طبقه بندی حداقل 10 نمونه از CNB به روش استریوتاکتیک هدایت شده است،لازم می باشد. رادیوگرافی نمونه (Specimen radiography) باید بطورروتین روی بافت پستان با روش CNB
استریوتاکتیک انجام گیرد با این هدف که ارزیابی پاتولوژی جهت دارشده و تعیین اینکه تقسیم بندی (Classitication ) بطورواقعی انجام شده است یا خیر.یک مشکل که دراین تکنیک وجود دارد احتمال عدم برداشتن نمونه ازضایعه سرطانی است که منجربه تشخیص منفی کاذب می شود. دریک مطالعه چند مرکزی (Multiinstitutional)، در 5/4% زنان که با CNB بررسی استریوتاکتیک شده بودند،و یک ضایعه خوش خیم درآنها تشخیص داده شده بودند،درطول follow-up تشخیص کار سینوم مطرح شد. طرفداران CNB استریوتاکتیک کارسینوم مطرح شد.طرفداران CNB استریوتاکتیک براین عقیده اند که هرچند در بعضی موارد در این تکنیک عدم تشخیص وجود دارد ولی تاحدود 20% ضایعات غیرقابل لمس در بیوپسی اکسیزیونال که با تصویرهدایت می شود (image directed) نیزخطر عدم تشخیص وجود دارد.با این حال از طریق رادیولوژیست ها و جراحانی که در بیوپسی اکسیزیونی که با needle-wire localization هدایت می شود مهارت کافی دارند تنها 0/2% تا 0/3% عدم تشخیص گزارش می شود.بعلاوه رادیوگرافی ضایعه خارج شده بالافاصله موارد خطا را نشان می دهد که می توانند به راحتی تحت درمان قرارگیرند.میزان منفی کاذب های حقیقی برای CNB هدایت شده با استریوتاکتیک مشخص نمی باشد چراکه بیشترمطالعات ثبت شده هیچ follow - up دقیقی (حداقل 2 تا 3 سال) را که برای تشخیص موارد منفی کاذب لازم است،انجام نداده اند.اندیکاسیون ها و کنترااندیکاسیون های نسبی برای CNB استریوتاکتیک به نحوه انجام (Practice) و تجربه پزشکی که بیوپسی را انجام می دهد، بستگی دارد (جدول 4).
آخرین روش در تعیین ضایعه ها اولتراسونوگرافی است.پیشرفته تجهیزات اولترسوند باعث شده است که ما قادر به لوکالیزه کردن و انجام بیوپسی توده های غیر قابل لمس باشیم.وجود یک رادیولوژیست ماهر و ارتباط صمیمانه بین جراح و رادیولوژیست درتجویزتکنیک درست بیوپسی لازم است.
وضعیت های خوش خیم
هیچ ضایعه ای وجود ندارد که بطور واضح خوش خیم باشد.بعضی بیماران دچار توده هایی نامنظم و حساس می شوند که احتمالاً مربوط به تروما است ولی این بیماران هیچ واقعه خاصی را بیاد ندارند.
جدول 4:اندیکاسیون ها و کنتراندیکاسیون های نسبی بیوپسی در Core-needle تحت راهنمایی استرئوتاکتیک
|
اندیکاسیون ها*
*یک توده توپر،غیر قابل لمس با:
شکل نا منظم
حاشیه های مضرس یا نامنظم
میکرولوبولاسیون
کالسیفیکاسیون های مشکوک
یافته های همراه از قبیل
ضخامت موضعی پوست
مجرای دیلاته منفرد موضعی
*میکرو کالسیفیکاسیون با تظاهرات زیر:
مورفولوژی :سایز یا شکل متغیر (پلئومورفیک)شاخه دار یا گرانولار
انتشار :خوشه ای (گروهی )،خطر یا منطقه ای
*ناحیه مشکوک به درهم ریختگی ساختمانی در بیوپسی شناخته شده قبلی که نشاندهنده یک تغییر مشکوک از ماموگرام قبلی است.
*آسیمتری همراه با کالسیفیکاسیون های مشکوک ،در هم ریختگی ساختمانی ،توده غیر کیستی ،مجرای دیلاته یا ضخامت موضعی پوست.
کنتراندیکاسیون*
*ضایعات خوش خیم یا احتمالاً خوش خیم مانند :
توده هایی که:
*محدوده ی کاملاً مشخصی داشته،دانسیته پایین و قطر <1 سانتی متر دارند ،مگر مواردی که ماموگرام قبلی تغییراتی نشان داده اند.
*شامل چربی داخل ضایعه هستند که پاتوگنومونیک غده لنفاوی ،کیست چربی یا هامارتوماست.
*متعدد ،غیر کلسیفیه و با حاشیه مشخص هستند.
میکروکالسیفیکاسیون های :
*کوچک،گرد یا بیضی ،متحد الشکل و به صورت خوشه ای متمرکزند.
*در یک خوشه (یا خوشه های متعدد )که موید شیر کلسیم ،بیماری ترشحی یا آدنوزاسکروزه است.
*منتشر و غیر خوشه ای که مؤید شیر کلسیم MILK OF CALCIUM بیماری های ترشحی یا آدنوزاسکروزه است.
توده های Unequivocal ،قابل لمس *
|
بعضی دیگر بصورت ضخیم شدگی در ناحیه 1/4 فوقانی خارجی پستان که نامنظم و حساس می باشند تظاهرمی کنند.این حالت معمولاً کیستیک بوده و به تغییرات فیبروکیستیک نسبت داده می شود.پزشک باید در ابتدا سرطان پستان را قبل از اینکه خوش خیم بودن را مطرح کند،رد نماید.
تغییرات فیبروکیستیک
شایع ترین شرایط خوش خیم پستان، تغییرات فیبروکیستیک می باشد(FCC).این تغییرات یک واکنش شدید و افزایش یافته بافت پستان به تغییرات سطح هورمونهای تخمدان است.میزان بروز FCC در میان زنان 20 تا 50 ساله که در دوره تولید مثل قرار دارند درحداکثر میزان خود می باشد. شایعترین نشانه FCC،درد (mastodynia) است.بدلیل ترسی که از سرطان پستان وجود دارد،هرناراحتی در قفسه سینه قدامی بعنوان درد پستان وجود دارد،هرناراحتی در قفسه سینه قدامی بعنوان درد پستان عوامل زیادی درایجاد درد قفسه سینه قدامی مطرح می باشند.از این عوامل می تواند به آشالازی، رادیکولیت گردنی،فتق هیاتال، کوستوکوندریت (سندرم Tietze)، نورالژی،دنده گردنی،کوله لیتیازیس، بیماری های عروق کرونر،میالژی، پلورزی،درد عضو خیالی (Phantom pain)،ضربه یا زونا اشاره نمود.درد ناشی از FCC معمولاً دو طرفه بوده و در فاز قبل ازقاعدگی قابل توجه می باشد. برجسته بودن (Lumpiness ) و ندولاریته ممکن است یک طرفه یا دو طرفه، و لوکالیزه یا ژنرالیزه باشد.معمولاً ترشح خودبخودی ازنوک پستان وجود دارد.سن، وضعیت ژنتیکی و سابقه شیر دادن کمکی بر FCC تأثیردارند.
پاتوژنز این بیماری بطور واضح مشخص نیست ولی بنظر می رسد که ماحصل عدم تعادل بین سطوح استروژن و پروژسترون است.تغییرات دوره ای بافت پستان تحت تأثیر هورمونها باعث ایجاد تغییرات در سلول های اپیتلیال واسترومال می شود. فاکتورهای خطر (Risk Factors ) عبارتند از :نولی پاریتی،یائسگی در سن بالا، و سطح بالای اجتماعی-اقتصادی.
زنانی که در معرض بالاترین خطرایجاد سرطان پستان قرار دارند -خطر 11 برابر - دارای سابقه فامیلی مثبت از نظر سرطان پستان بوده و در بیوپسی آتیپی سلولی را نشان می دهند. در صورتی که تغییرات پرولیفراتیو همراه با آتیپی وجود نداشته باشد،FCC یک ریسک فاکتور برای کانسر محسوب می شود و خوشبختانه این موضوع درمیان اغلب زنان صادق است. FCC نوعی تغییرهیستولوژیک بوده و از نظر پروگنوز به سه گروه تقسیم می شود. پرولیفراتیو،تغییرات پرولیفراتیو با آتیپی، پرولیفراتیوبدون آتیپی.درمیان بیوپسی های پستان که FCC را نشان می دهند،70% در گروه غیرپرولیفراتیو که خطری برای ایجاد سرطان ندارند قرار می گیرند.ازضایعات پرولیفراتیو (30%) ، 26% هیچ تغییرآتیپی را نشان نمی دهند و خطر واضحی برای ایجاد سرطان وجود ندارد؛درحالی که 4% آتیپی سلولی را نشان داده و پنج برابر خط سرطان پستان درآنها وجود دارد.
زنانی که شکایت های مربوطه به FCC دارند،باید آزمایشات کامل پستان را داشته باشند.بسیاری از نشانه ها با درمان های طبی درمان می شود ولی به هرحال بیوپسی بافتی توده (Lump) سه بعدی لازم و اجباری است.از درمان های طبی برای FCC سمپتوماتیک استفاده می شود.می توان به بستن سینه بندهای محافظتی در تمام زمانها برای کاهش درد و سنگینی،اشاره کرد. دیورتیک ها بویژه در فاز قبل از قاعدگی می توانند بطور گذرا باعث کاهش نارحتی شوند.مطالعات انجام شده توانسته است بین مصرف متیل گزانتین ها (مانند کافئین) و تنباکو و ایجاد FCC ارتباطی را نشان دهد.دراین مورد در 24% موارد علائم کلینیکی به دنبال کاهش مصرف تنباکو و متیل گزانتین بهبودی نشان داده است. اگر چه بعضی این امر را مردود دانسته اند ولی به هرحال کاهش مصرف کافئین ضرری ندارد و ممکن است برای بیماران علامت دار مفید باشد.
قرص های ضد بارداری خوراکی در فاز ترشحی سیکل قاعدگی از اثرات کنترل درد برخوردارند.دانازول (Danocrine) داروی ترجیحی در درمان FCC با نشانه های شدید است. یک دوره 3 تا 6 ماهه دانازول 100 تا 400 میلی گرم در روز، باعث حذف درد و ندولاریته در حدود 69% زنان می شود و در 30% باقی مانده موجب کاهش علائم و نشانه ها می گردد.این درمان باعث می شود که توده غالب با کاهش یا حذف ندول های اضافی در اثر درمان جلب توجه کردن و به این وسیله نیاز به بیوپسی های اضافه کاهش یابد.
فیبروآدنوم
با اولتراسوند و FNA می توان بین فیبروآدنوم و کیست افتراق قائل شد. فیبروآدنوم ها توده های خوش خیم پستانی می باشند که درحدود 10% زنان دیده می شود.فیبروآدنوم درتمام گروههای سنی ایجاد می شود ولی بطور عمده در دهه سوم و چهارم بروز می کند.با افزایش سن میزان بروز آن کاهش می یابد.فیبرآدنوم های متعدد در 12 تا 20% موارد دیده شده و معمولاً دو طرف هستند.این توده های نرم، گرد و متحرک که در لمس سفت هستند. معمولاً در معاینه پستان یافت می شوند. آزمون های سیتولوژیک در معاینه پستان یافت می شوند.آزمون های سپتولوژیک مواد آسپیرده شده ازفیبروآدونوم ها مشخص کننده لایه های منفرد از سلولهای اپیتلیال و داکتال خوش خیم با استرومای متراکم و هسته های دراز و فراوان است.
هنگانی که فیبروآدنوم مورد شک باشد، ماموگرافی دررد سرطان کمک کننده نیست. یک ضایعه مشکوک کلینیکی باید با اکسیزیون کامل ارزیابی و بررسی شود. هنگامی که سیتولوژی تشخیص میکروآدنوم را روشن کرد،می توان توده را بحال خود رها نمود و فقط معاینه شخصی ماهانه ( Self-examination) و معاینه بالینی پستان به طور سالیانه ماموگرافی های منظم غربالگری انجام شود.بعضی فیبروآدنوم ها بطورخودبخود پیشرفت کرده (regress) و بعنوان ضایعات پیش بدخیم در نظر گرفته نمی شوند.در 20% موارد فیبرآدنوم عود می کند.
اکسیزیون جراحی بیوپسی در موارد زیر توصیه می شود:
* توده باعث درد شده یا مرتباً بزرگ شود.
* نتیجه FNA نامشخص یا به هرحال مشکوک است.
* بیمار نیازبه ابراز اطمینان بخشی دارد که بوسیله بیوپسی قابل انجام است.
توده های دیگرخوش خیم مانند آدنوم توبولار و هماتوم معمولاً با فیبروآدنوم اشتباه می شوند.
ترشح از نوک پستان
ترشح از نوک پستان عبارت است از درناژ واقعی که ازمجاری پستان خارج شده و در سطح نوک پستان قرار می گیرد.این ترشح ممکن است شیری - غلیظ بوده،و مطرح کننده گالاکتوره،باشد. برای اینکه ترشح قابل توجه باشد،باید این ترشح،مداوم، واقعی و خودبخودی بوده و مربوط به شیر دادن نباشد.عامل ترشح غیر خودبخودی از مجاری متعدد از هردو پستان معمولاً فارماکولوژیک یا آندوکرینولوژیک است.
شایع ترین علت از علل متعدد ترشح نیپل، اکتازی لوله ها و مجاری پستانی است که باعث ترشح به رنگ های مختلف (منجمله سبز،سفید، قهوه ای،خاکستری یا قرمز- قهوه ای) می شود. رنگ قرمز - قهوه ای معمولاً با ترشحات خونی اشتباه می شود. بنظر می رسد که این ترشح بعلت ترشحات گلاندولار و تولید مایع چربی آزاردهنده باشد. ترشحات مجاری پستانی گشاد شده در زنان میان سال دیده می شود.
علت بسیار شایع بعدی ترشحات چسبنده با رنگ های مختلف،ماستیت غیرپورپورال است.این نوع ماستیت به دو نوع مداوم (Persistent) و گذرا (Transient) تقسیم می شود نوع مداوم شامل التهاب در نواحی عمقی پستان است،حال آنکه نوع گذرا با التهاب پری آرئولارهمراهی دارد. در صورتی که ضایعه بصورت یک توده التهابی درآید اکسیزیون جراحی و درناژ ضروری خواهد بود.درمان طبی وموضعی، پرهیزازدستکاری نیپل،استفاده از داروهای NSAIDS،بروموکریپتین و آنتی بیوتیک های ضد استافیلوکوکی معمولاً هنگامی که فقط عفونت مورد شک باشد مفید است.
پاپیلومای داخل مجرائی شایع ترین علت ترشح از نوک پستان است.این ترشحات مداوم و خونی نیازبه بررسی بیشتر را نشان می دهد.خطر سرطان هنگامی که :1- ترشحات یک طرفه و ازیک مجرا باشد.. 2- ترشح در زن یائسه باشدو 3- توده وجود داشته باشد افزایش می یابد.
در جریان معاینه پستان،پزشک باید بدنبال یک توده پری آرئولار بگردد.معاینه شامل لمس دقیق و آرام نواحی ساب آرئولار برای مشخص کردن نواحی که با فشار ترشح دارند، است.دراین بررسی ایجاد مجدد ترشح و مشخص کردن ربعی از پستان که ترشح از آنجا خارج می شود بسیار پر اهمیت است. تمام ترشحات واضح نیپل تاکیدی براقدام برای بیوپسی بافتی هستند، اگر چه توده معمولاً هنگامی که ترشح در اثر سرطان باشد وجود دارد ولی حدود 13% موارد سرطان هایی که ایجاد ترشح می کنند،هیچ توده قابل لمسی وجود ندارد. علاوه براین پزشک نباید تنها به سیتولوژی مواد ترشحی تکیه نماید چرا که در 18% موارد،منفی کاذب و 2/6% موارد مثبت کاذب در سیتولوژی استاندارد وجود دارد گالاکتوگرافی (تزریق ماده رادیوپاک در مجاری که ترشح
دارند و سپس انجام ماموگرافی) تصویر بهتری از پاپیلاهای درون مجرایی در اختیارگذارده ولی نمی تواند بین ضایعات خوش خیم و بدخیم افتراق قائل شود لذا انجام جراحی همچنان ضروری است. ماموگرافی دربیماری که دچارترشح نیپل دراثرسرطان است 9/5% منفی کاذب و 1/6% مثبت کاذب دارد.
یک شرح دقیق و معاینه فیزیکی کامل باید خودبخودی بودن، راجعه بودن،یکطرفه بودن ترشح را روشن کند.اگر ترشح اولین بار درسینه بند یا لباس شب بیمار دیده شد ازاهمیت بیشتری نسبت به ترشح در طول مدت کاردرلباس روزانه برخوردار است. باید توجه کرد که ترشحات بعد از یائسگی اهمیت بسیار دارند.ترشحات خونی خودبخودی معمولاً در سه ماهه سوم حاملگی،فیزیولوژیک تلقی شده و نیاز به هیچ مداخله ای ندارند مگر در صورتی که چندین ماه بعد از زایمان همچنان ادامه یابند. بیمارانی که اینگونه ترشحات را دارند باید بدانند که هیچ کنتراندیکاسیون خاصی در مورد شیردادن در این مورد وجود ندارد.
توده های کاذب در دوران نوجوانی
خطر سرطان پستان در دوران نوجوانی قابل اغماض است.تکامل پستان در دوران نوجوانی با تشکیل جوانه پستانی آغاز می شود.شکل و ظاهر جوانه پستانی می تواند باعث احساس خطر وشک به سرطان پستان شود.یک برجستگی یک طرفه معمولاً در اثرتاخیر رشد جوانه پستانی در پستان دیگر است. FNA یا بیوپسی دراین مورد لازم نیست و حتی بیوپسی باعث آسیب به بیمارجوان شده و با رشد طبیعی پستان تداخل دارد.سونوگرافی در صورت لزوم تنها وسیله بررسی و ارزیابی است.
ماستیت
ماستیت یک عفونت است و شایع ترین مشکل پستان دردوران شیردهی و حاملگی می باشد.این بیماری باعث تب، دردو تورم در پستان می شود.علت ماستیت به باقی ماندن شیر در پستان بر می گردد که محیط مناسبی برای رشد باکتری ها است. استاف طلایی شایع ترین عامل عفونی در این مورد بوده،درمان آنتی بیوتیکی یک دوره پنی سیلین G یا داکسی سیکلین سدیم 250 میلی گرم خوراکی چهار باردرروز است. زنانی که دچار ماستیت می شوند ممکن است بتوانند به شیردهی ادامه دهند.در صورتی که عفونت به درمان پاسخ ندهد حضورآبسه محتمل است.دراین صورت درناژ همراه با ادامه آنتی بیوتیکی لازم می باشد.درموارد مقاوم که بنظر می رسد عفونت تمام پستان را در برگرفته است، رد کردن کارسینوم التهابی ضروری است. گالاکتوسل،شامل کیست هایی است که با شیر پرشده اند و احتمالاً در اثر انسداد مجاری شیری بوجود می آیند.این کیست ها بطور تیپیک حساس بوده و در محیط پستان ایجاد می شوند.بنظر می رسد که گالاکتوسل زمینه ساز ایجاد کیست های پستانی و FCC باشد.آسپیراسیون شیراز کیست ها که دربعضی موارد چندین بار لازم است. معمولاً باعث کاهش ناراحتی و برطرف شدن مشکل می شود. پوست و کمپلکس نیپل -آرئول نیاز به توجه خاصی دراند. دلمه بستن مداوم نیپل می تواند مطرح کننده بیماری پاژه باشد. دراین مورد و رتراکسیون اخیر و توجیه نشده نیپل باید بیوپسی انجام شود.
متاپلازی اسکواموس پستان یک روند خوش خیم است که نباید با سرطان پستان اشتباه شود.این فرم شایع ترین شکل ماستیت غیر نفاسی(nonpuerperal) می باشد. متاپلازی اسکواموس تغییر شکل اپتیلوم مخاطی و گلاندولار اپی اتیلوم سنگفرشی مطبق می باشد،این حالت ممکن است بعد از ضربه هنگامی که نکروز چربی ضخیم می شود یا اریتم وجود دارد،بوجود آید.دو نوع متاپلازی ممکن است درپستان اتفاق افتد: 1- آپوکرین 2- سنگفرشی. این وضعیت می تواند تقلید کننده گشاد شدگی مجرا یا پاپیلومای داخل مجرائی باشد.درمان اکسیزیون ساده است.درصورتی که مجرای (tract) فیستولی راجعه ایجاد شود، برداشتن کل مسیر (tract) توصیه می شود.مهمترین قدم در تشخیص افتراقی،رد کارسینوم التهابی است.برای این کار بیوپسی افتراقی،رد کارسیوم التهابی است. برای این کار بیوپسی اکسیزیونی ساده که خود درمان برای متاپلازی سنگفرشی می باشد قابل انجام است.
کارسینوم پستان
مرحله بندی (Staging)
تشخیص سرطان پستان معمولاً با بیوپسی جراحی یا بیوپسی رادیولوژیک مرکزی به انجام می رسد.بررسی سیتولوژیک FNA در مطب باعث تشخیص سریع تر می گردد و موجب می شود که پزشک بتواند قبل از هر جراحی مشاوره بهتری را به بیماران ارائه کند.بسیاری از
تشخیص های هیستولوژیک در زمان جراحی تائید می شود.
Staging سرطان پستان با سیستم TNM انجام می شود.با این حال بسیاری از پزشکان معتقدند که این سیستم نمی تواند بطور قابل قبولی بیماران را طبقه بندی کرده و درمان جراحی مناسب را انتخاب کند.مثلاً بیماری که ازنظرکلینیکی فاقد غده لنفاوی مشخص است ممکن است بطور هیستولوژیک درگیری غدد لنفاوی داشته باشد.بعلاوه بنظر می رسد که حدود 25% بیمارانی که به ظاهر دارای غدد لنفاوی بالینی هستند از نظرهیستولوژیک نتیجه منفی دارند و در ضمن تخمین اندازه تومور بطور دقیق امکان پذیرنمی باشد.درلمس، یک توده با التهاب اطراف و کارسینوم درجا ممکن است نواحیی را شامل شود که بطور کامل از سلول های بدخیم تشکیل نشده است.Staging باید برطبق دستورکالج جراحان آمریکا درفایل های مربوط به تومور بیمارستان ثبت شود.مطالعات نشان می دهدکه 5% بیماران دارای بیماری همزمان یا چند مرکزی (multicentric) می باشند که برانجام ماموگرافی قبل از درمان سرطان تاکید می کند.
دو نوع سرطان پستان غیرمهاجم ازنظر هیستولوژیک وجود دارد:کارسینوم داکتال در جا (DCIS) و لوبولارکارسینوم مهاجم (LCIS) بطورآماری حدود 72% سرطان های پستان مهاجم ازنوع اول می باشد حال آنکه تومورلوبولار انفیلتراتیو 10 تا 15% این موارد را در بر می گیرد.بیماری پاژه کارسینوم التهابی و سارکوما مابقی موارد را شامل می شود.(BCDDP(Breast Cancer Detection Demonstration اخیراً داده های 20 ساله خود را در زمینه پیگیری بیماران منتشر کرده است.غربالگری برای سرطان پستان بوضوح باعث تشخیص زودرس سرطان پستان شده،وراهگشای خوبی در جهت جراحی های حفظ کننده پستان است. BCDDP یک غربالگری 5 ساله با معاینه فیزیکی و دو تصویر ماموگرافی از 280000 زن داوطلب در تمام ایالات متحده انجام داده است.ازمیان 4057زن در سالهای بین 1973 تا 1980 که تشخیص سرطان پستان درآنها داده شده بود، 2658 زن (66%) زنده بودند.درصد بالائی از این تومورها با ماموگرافی پیدا شده بود و 28/6% از تمام این سرطان ها کوچکتر از 1cm بود،میزان زنده بودن (survival rate) برای کل گروه حدود 80/5% بود. میزان زنده بودن مشاهده شده 61/7% بود. فاکتورهای پیش آگهی در این مورد وضعیت لنف نودها و وضعیت سرطان درزمان تشخیص بود. مطالعه رقم 85/5% را برای میزان زنده بودن در کسانی که سرطان پستان مهاجم با لنف نود منفی داشتند محاسبه کرده بود و درکسانی که دچارسرطان مهاجم با قطرکمتراز1cm بودند این رقم حدود 90/2% بود.
گزینه های درمانی (treatment options)
مهمترین گزینه درمانی برای سرطان مهاجم،رادیکال ماستکتومی تعدیل یافته (modified)یا روش های حفظ پستان مانند لامپکتومی (lumpectomy) و تخلیه غدد لنفاوی زیربغل همراه با رادیو تراپی است.برنامه ریزی درمانی برای سرطان پستان شامل رویکردهای چند بخشی می باشد.اگرچه هربیمارباید با یک پزشک مشورت کند ولی گزینه های درمانی نیاز به مهارت جراح،رادیوتراپیست و انکولوژیست دارد.دربعضی جاها پزشک موظف به معرفی و بحث درمورد درمانهای جایگزین با بیماراست.
با مرورداده های بالینی نکته قابل قبول بنظر می رسد که درمان جراحی با حفظ پستان و رادیوتراپی یک جایگزین مناسب برای ماستکتومی است (شکل5). در یک کنفرانس که درماه ژوئن سال 1990 توسط انستیتو ملی سرطان برگزار گردید اینگونه نتیجه گیری شد که درمان های محافظت کننده پستان یک متد و روش مناسب برای درمان اولیه بیشتر زنان با مراحل I و II سرطان پستان است و این درمان به دلیل اینکه از نظر قابلیت زنده ماندن (survival) اثر برابری با ماستکتومی یا تشریح غدد لنفاوی زیر بغلی با حفظ پستان دارد به عنوان درمان ترجیحی قابل قبول می باشد. برداشتن کامل پستان با ماستکتومی رادیکال تغییر یافته،فاسیای پکتورالیس ماژور و سطوح I وII غدد لنفاوی زیربغلی را در بر می گیرد وعضلات پکتورالیس را حفظ می کند. یک عمل جراحی محافظه کارانه اکسیزیون گسترده بافت مجاور پوست پستان است. Quadranectomy برداشتن تومور و روی آن و ربع درگیر پستان می باشد.تمام این درمان ها با تشریح غدد لنفاوی زیر بغلی سطوح I و II همراه است(برداشتن محتویات زیر بغلی ازدم پستان تا لاتیسموس دورسی- حاشیه خارجی عضله پکتورالیس ماژور تا زیر عضله پکتورالیس مینور،ازبالا ورید اگزیلاری و لبه کناری عضله پکتورالیس مینورتا زیر پکتورالیس مینور در داخل است(شکل 5).
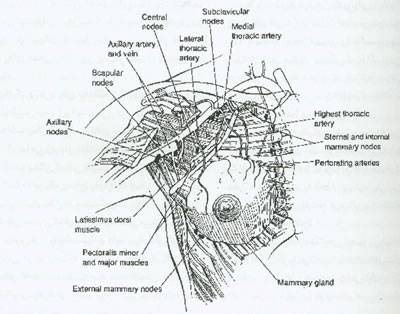
ازنظربیمارحتی یک ماستکتومی ساده نیز یک عمل رادیکال حساب می شود.این عمل گویای برداشتن کل پستان شامل کمپلکس نیپل - آرئول و فاسیای روی پکتورالیس ماژوراست. درمان رادیکال ماستکتومی تغییر یافته درموارد زیر درمان ترجیحی است:
* بیمارانی که LCIS یا DCIS چند کانونی دارند.
* بیمارانی که دچار عود تومور بعداز ماستکتومی ناقص شده اند و بیمارانی که غدد لنفاوی زیر بغل آنها تشریح شده یا رادیاسیون ناحیه زیر بغلی داشته اند،ولی رادیاسیون پستان دریافت نکرده اند.
* دربیماران انتخاب شده ای که برداشتن پروفیلاکتیک پستان مقابل توصیه می شود.
*بیماران مسن یا بیمارانی که خطرعمل بالائی نداشته و هیچ آدنوپاتی زیر بغلی و شواهد بیماری دور(distant disease) را ندارند.
* بیماران با ضایعه حجیم و زخمی با متاستاز دور دست که کنترل موضعی باعث بهبود کیفیت زندگی آنها می شود.
عوامل مختلفی برانتخاب درمان جراحی تاثیرمی گذارد منجمله اندازه و موقیعت تومور واندازه پستان بیمارانی که کاندید مناسبی برای درمان محافظه کارانه پستان نیستند عبارتند از کسانی که دچار تومور بزرگ یا منتشر و چند کانونی بوده یا پستان کوچکی دارند.سن برای حفظ پستان هیچ کنترااندیکاسیونی برای این عمل جراحی ایجاد نمی کند.
مطالعات به این نکته اشاره دارد که حتی در ماستکتومی زیرجلدی که به بهترین نحو انجام گرفته باشد،در 80% مواد بافت پستان در نواحی زیر آرئول و سایر نقاط باقی
می ماند.ماستکتومی زیر جلدی به این علت که تمام بافت پستانی را پرنمی دارد دیگر توصیه نمی شود. اگر یک پروسه درمانی پروفیلاکتیک لازم است منطقی بنظر می رسد که برداشتن کل بافت پستان توصیه شود.هرچند که هیچ مطالعه ای در مورد اینکه نشان دهد برداشتن 80% بافت پستان ممکن است کاهش مشابه ای در میزان خطر پدید آورد،وجود ندارد.ماستکتومی زیر جلدی علاوه براینکه ازنظرعمل پروفیلاکتیک کمتررضایت بخش است، نتایج متفاوتی از نظر زیبایی دارد.هنگامی که سرطان پستان زود تشخیص داده می شود جراحی محافظه کارانه پستان بهترین نوع درمان برای بسیاری از بیماران است. این جراحی معمولاً با درمان های کمکی رادیوسیون پس از بهبودی پستان همراه می شود.
بکارگیری درمانهای محافظه کارانه و رادیوتراپی نیازمند درنظر داشتن موارد زیر است:
1-انتخاب بیمار 2- جراحی توموراولیه 3- رادیوتراپی توموراولیه 4-جراحی زیر بغل.کاندیداهای نامناسب برای درمان حفظ کننده پستان کسانی هستند که دچار تومور اولیه ای که بطورگسترده در یک پستان وجود دارد،کسانی که یک تومور بزرگ در یک پستان به نسبت کوچک دارند یا کسانی که ماموگرافی بیماری گسترده را در آنها نشان می دهد.مهمترین اصل برتری در دمان کنسرواتیو جنبه زیبایی آن است.هیچ اطلاعاتی درمورد اینکه رویکرد محافظه کارانه باعث بهبودی survival نسبت به ماستکتومی رادیکال یا ماستکتومی رادیکال تغییر یافته می شود،وجود ندارد.بنابراین مهمترین معیار برای انتخاب بیمار قابلیت برداشتن کافی تومور بدون بد شکل ظاهری است. بیمارانی با ضایعات مرکزی که دچار درگیری کمپلکس نیپل - آرئول می باشند می توانند بطور موفقیت آمیزی با برداشتن کمپلکس نیپل - آرئول و توجه خاص به نتیجه زیبایی پایانی درمان شوند.
برداشتن کافی ضایعات به معنای وجود حاشیه پاک (clear margin) است. جراح باید نمونه را برای اطلاعات پاتولوژیست علامت گذاری نماید.تعیین فاصله تومور با نزدیک ترین حاشیه بسیار اهمیت دارد. قسمتی از بافت باید برای مطالعات رسپتوری از نظراستروژن و پروژسترون برداشته شود.درگیری میکروسکوپی معمولاً در زمان بررسی برش های دائمی تشخیص داده می شود.اگر جراح قصد خارج کردن مجدد (recxcise) ضایعه،چند هفته پس از بپوسی را داشته باشد.درمحل عمل باید تورم و اکیموز در حداقل ممکن باشد.درغیراینصورت بررسی ضایعه و بدست آوردن نتیجه زیبایی دلخواه غیر ممکن خواهد بود.تشریح لنفاتیک زیر بغل برای تعیین مداخله (stage) متناسب با غدد لنفاوی ضروری است.
هنگامی که روش جراحی به منظورحفظ پستان انتخاب می شود رادیوتراپی پستان در اسرع وقت بعد از بهبودی زخم ها باید شروع شود.این رادیوتراپی با 1/8 تا 2Gy در هر روز و بطور کلی 45 تا 50Gy انجام می شود.دوزهای بیش از 50Gy باعث ایجاد فیبروز،رتراکسیون و نتایج زیبایی غیرقابل قبول می شود.بیمارانی که با اکسیزیون لوکال وسیع درمان می شوند و درآنها حاشیه برش در بررسی میکروسکوپی بسته (close) است، 15Gy-10 الکترون تراپی در محل عمل توصیه می شود.
درمورد اینکه بکارگیری همزمان کموتراپی و رادیوتراپی یا تجویز درمان تکمیلی کموتراپی بصورت ترتیبی (sequence) همراه با رادیوتراپی فایده ای دارد یا نه توافقی وجود ندارد.تصمیم به انجام این درمانها باید با مشورت با انکولوژیست های اشعه درمانی (radation) وطبی (medical) انجام شود.
درصورتی که ماستکتومی توصیه می شود، تمام بیماران باید ازامکان بازسازی (reconstruction) پستان آگاه شوند. بازسازی را می تواند همراه با جراحی اولیه یا با تاخیرانجام داد.تاخیر دربازسازی به معنای صبر تا پایان تکمیل درمانهای کمکی مانند کموتراپی یا رادیوتراپی است. تصورشکل غیر عادی همواره وجود داشته است لذا سازگاری فیزیکی و ذهنی با تشخیص سرطان پستان و برداشتن آن یک بخش مهم درپروسه بهبودی است و بازسازی پستان
یک وجه حیاتی این پروسه بهبودی در بعضی بیماران می باشد.انواع بازسازی ها شامل استفاده از پروتز پرشده با سالین جهت ایجاد برآمدگی یا بازسازی با فلاپ جلدی عضلانی مانند استفاده ازعضله راست شکمی است.تصمیم برای بازسازی معمولاً توسط بیمار و گروه جراحی وی گرفته می شود.این تصمیمات به مشکلات طبی،شرایط قبل ازعمل و فیزیک بدنی بستگی دارد.
نقش تشریح غدد لنفاوی در درمان محافظه کارانه سرطان پستان بخوبی روشن شده است.این غدد بعنوان یک راهنما برای توصیه برطبق درمان سیستمیک مطرح می باشند.امروزه جراحان هرسه لایه غدد لنفاوی را برنمی دارند بلکه بطورمعمول سطح I و بخشی ازسطح II را برمی دارند و عمل تشریح غدد لنفاوی ممکن است با ادم (5%) سروما (10%)، پارستزی (3-4%) و درد همراه باشد.
متخصصان سرطان پستان در حال بررسی و نقشه برداری (mapping) لنفاتیک و بیوپسی گروه های نگهبان (sentinel) بعنوان یک جایگزین برای تشریح استاندارد غدد سطوح I و II می باشند.این روش باعث کاهش مشکلات (Complications) شده و درعین حال دارای همان پروگنوز نیز می باشد.بیماران قبل از عمل،باید سینتی گرافی لنفاوی را انجام دهند و تزریق ردیاب کولوئید که حوزه لنفاوی در معرض متاستاژ و محل گره های نگهبان را نشان می دهد را داشته باشند.درحین عمل ماده رادیوکلوئید در اطراف توموراولیه تزریق می شود که توسط سیستم لنفاتیک برداشت می شود. پروب (probe) دستی گاما که مقادیر کولوئید تزریق شده را در طول سینتی گرافی لنفاوی نشان می دهد.برای یافتن گره نگهبان استفاده می شود (شکل6).این روش به دلیل اینکه سبب می شود جراح فقط یک یا دو گره نگهبان را به پاتولوژیست تحویل دهد بسیارموثراست.اگراین گره ها از نظر بدخیمی منفی بودند.هیچ تشریح بیشتری لازم نخواهد بود.درصورت تشخیص میکرومتاستازها در گره نگهبان یا اگر گره نگهبان درپروسه سینتی گرافی مشخص نشده.تشریح استاندارد گره های لنفاوی باید انجام شود.درروش نقشه برداری لنفاوی حساسیت را می توان با رنگ آمیزی ایمونوهیستوشیمی،برش های پشت سرهم (serial) و آنالیزگره نگهبان بروش reverse - transcriptase polymerase افزایش داد.
&&&&&&&&&&
برنامه جامع پستان در مرکز سرطان H. Lee Mofitt در تامپا (Tampa)، فلوریدا،گزارشی را در مورد نقشه برداری لنفاوی 62 زن که تشخیص اخیر سرطان پستان را داشته اند منتشر کرده است.در 57 مورد،روش گره نگهبان موفقیت آمیز بود (92%) .در18 بیمار (29%)بیماری متاستاتیک کشف گردید و گره نگهبان از نظر متاستازدرتمام آنها نتیجه را مثبت نشان داد.هیچ متاستازازقلم افتاده ای (Skip) که بصورت نتیجه منفی درگره نگهبان و نتیجه مثبت درگره های بالاترتعریف شود،وجود نداشت.
کارسینوم درجا
کارسینوم درجای داخل مجرائی (DCIS) یک نوع سرطان پستان است که غیر طبیعی بودن سلولی (Cellular abnormality) به اپی تلیوم مجرائی محدود بوده و هنوز غشاء پایه را پاره نکرده است. DCIS معمولاً با لمس کشف نمی شود چرا که این بیماری باعث ایجاد توده نمی گردد.این نوع کارسینوم به 4 تیپ هیستولوژیک بر مبنای شکل ساختاری تقسیم می شود:
کومدو (comedo)، میکروپاپیلری، Cribriform یا توپر (solid)،دربعضی موارد،تقسیم بندی به دو شکل کومدو و غیر کومدو خلاصه می شود.با بوجود آمدن ماموگرافی جهت غربالگری،میزان بروز DCIS تا حدود 20% از سرطان های پستانی که با ماموگرافی تشخیص داده می شوند رسیده است. DCIS بعنوان یک بیماری چند مرکزی مطرح می باشد.
ماستکتومی درمان استاندارد برای DCIS است.درطول 10 سال چیزی حدود 1% عود وجود دارد و میزان احتمال مثبت بودن غدد لنفاوی کمتراز1% می باشد.چند کانونی بودن درنوع کومدو شایع تر از نوع غیر کومدو است. در موارد DCIS تک کانونی ،عمل حفظ پستان مد نظر قرارمی گیرد.دراین مورد این نکته مهم است که حاشیه ضایعه باید عاری از مشکل باشد و معمولاً به قسمت های دیگربافت پستان اشعه تابانده می شود.
(National Surgical Adjuvant Breast NSABP) در مورد پروتکل B-17، میزان 10% برای لامپکتومی همراه با پرتودرمانی در مقایسه با میزان 21% جراحی اکسیزیونال تنها در طول 5 سال ارائه کرده است. مرکز سرطان پستان در Von Nuys کالیفرنیا در حال مطالعه خطر عود و نیاز به لامپکتومی یا ماستکتومی است.شاخص پیش
آگهی Von Nuys،به ضایعات بر مبنای یکی از سه فاکتورزیر نمره 1 تا 3 را می دهد:اندازه تومور،پهنای حاشیه (mgrgin wide) و تقسیم بندی پاتولوژیک (که با نکروز و grade هسته ای مشخص می شود).دراین روش این امکان وجود دارد که زیرگروههایی از بیماران که نیازی به پرتو درمانی ندارد را تعیین نمود.اگر چه میزان علاج (Cure rate) بعد ازماستکتومی در این کارسینوم از 96% فراتر می رود ولی سعی درحفظ پستان برای نتیجه بهتر زیبائی است.از آنجائی که بروزبیماری گره ای (nodal disease) کم است،بیماران با DCIS ممکن است تمایل به نقشه برداری لنفاوی از گروه نگهبان برای مشخص کردن پخش شدن بیماری داشته باشند.تشریح غدد لنفاوی در بسیاری ازبیماران با DCIS لزومی ندارد.
LCIS معمولاً بطوراتفاقی در بیوپسی پستان که بعلت ماموگرافی غیرطبیعی یا توده قابل لمس انجام گرفته است کشف می شود. تشخیص LCIS در جریان یک معاینه بالینی بسیار مشکل است.ممکن است یک ناحیه ضخیم جزئی درلمس یا ناحیه مختصر ظریف در ماموگرافی وجود داشته باشد، LCIS در3 تا 6% بیوپسی های پستان یافت می شود .
امروزه این موضوع توسط بسیاری از مراکز مورد قبول است که یک زمینه ژنتیکی مساعد برای بروز سرطان وجود دارد.این سرطان ممکن است مجرائی-لوبولی، مدولاری و غیره باشد که می تواند پستان را نیز درگیرکند.بسیاری از جراحان بر اینکه LCIS فقط بعنوان یک فاکتور خطر مانند سابقه فامیلی مطرح می باشند هم عقیده هستند.درمان LCIS بصورت یک بیوپسی اکسیزیونال به تنهایی است. بیمارانی که دچار LCIS می باشند،باید مانند کسانی که دارای سابقه فامیلی قوی هستند،تحت بررسی از نطر سرطان پستان قرارگیرند.
عوامل پیش آگهی
عوامل پیش آگهی که برای بیماری متاستاتیک استفاده می شود،وضعیت غدد لنفاوی و اندازه توموراست.این مطلب که غربالگری باعث مشخص کردن تومورهای کوچکتر درهنگام تشخیص شده است یک واقعیت اثبات شده است.در زنان با تومورهای حداکثر 1cm یا کمتر خطرعود کمتر از 10% است.با تشخیص زودتر بیماری به واسطه سطح تحصیلات بیمار و تجهیزات ماموگرافی بهتر،2/3 سرطان های پستان تازه تشخیص داده شده،دارای غدد لنفاوی زیر بغلی منفی می باشند. وضعیت غدد لنفاوی زیر بغلی مهمترین فاکتور در تعیین پیش آگهی بیماران مبتلا به سرطان پستان است.بیماران با گره های لنفاوی منفی و اندازه تومورکوچکتر از 2 سانتیمتر ازمیزان عودی حدود 11% برخوردارند که در مقایسه با رقم 22% برای تومورهای 2 تا 3 سانتیمتری و 24% برای تومورهای بزرگتر از 5cm قابل توجه نمی باشد.اندازه تومور بطورمستقل در پیش بینی عود بسیارمهم است.عود تومور از30% احتمال برای بیماربا گره لنفاوی منفی به 50 تا 60% در بیمار با 1 تا 3 گره مثبت و 85 تا 90% در 4 یا بیشتر گره مثبت افزایش می یابد.درگیری واضح گره لنفاوی یک نشانه پیش آگهی در مقایسه با درگیری میکروسکوپی می باشد.ازآنجا که عود بیماردرنهایت در 25 تا 30% بیماران که گره لنفاوی دارند رخ می دهد و در نهایت منجربه مرگ آنان می شود لذا فاکتورهای تعیین پیش آگهی دیگر نیز لازم می باشند.
این فاکتورها شامل موارد ذیل هستند:
1- وضعیت رسپتورهای استروژن (ER).
2- تهاجم عروق لنفاوی.
3- فعالیت تزایدی تومور
4- درجه (Grade)
5- زیرگونه هیستولوژیک.درجه بالای هسته نشانه میزان بالاترعود است.
ساب تیپ های بسیاری که دارای پروگنوز مناسبی هستند وجود دارند؛مانند ساب تیپ های توبولار و کولوئید (موسینوز) و پاپیلری،ضایعات لوبولر،مهاجم و ضایعات مدولری متوسط هستند درحالی که کارسینوم نگین انگشتری (Signet ring) و کارسینوم سارکوماتوئید پروگنوز بدی دارد. تعیین رسپتوهای استروژن و پروژسترون در زمان تشخیص یک روش استاندارد می باشد.پروگنوز 5 ساله بیماران ER مثبت 8 تا 10% بهتر از پروگنوز ER منفی ها است. تهاجم لنفاتیک اطراف تومور و تهاجم به عروق خونی یک فاکتورخطربسیاربد است که مستقل از سن و اندازه تومور می باشد. خطرعود در بیمارانی که تهاجم عروقی لنفاوی دارند 4/7 برابر بیشتر از کسانی است که دچار آن نیستند.این تهاجم در حدود 25% تمام سرطان های پستان و 15% سرطان های پستان که گره لنفاوی منفی دارند رخ می دهد. مارکرهای بیولوژیک تحقیقاتی متعددی برای ارزیابی خطر عود وجود دارد.این فاکتورها شامل NEU) erbB2) که محصول پروتئین انکوژن است، گیرنده فاکتور رشد اپیدرمال یا کاتپسین D،تعیین وجود عروق خونی کوچک (microvesseles)، بروز P53، پروتئین مربوط به هاپتوگلوبین پروتئین های شوک حرارتی (HSP) و PS2 می باشد.اگرچه این فاکتورها دارای ارزش پیش بینی کننده می باشند.ولی هیچ کدام نمی توانند به ویژگی 90% برای پیش بینی وجود یا عدم وجود بیماری میکرومتاستاتیک برسند.اندازه گیری پرولیفراسیون سلولی در نمونه های سرطان پستان با استفاده از تکنیک های مختلف یک ارتباط محکم با نتیجه (out come) نهایی را نشان می دهد. فلوسیتومتری DNA باعث فراهم آمدن امکان ارزیابی دقیق و قابل مشاهده برای
سیکل سلولی شده است که از روش Thymidin Labelling Index ساده تر است.محتوی DNA و طول دوره فاز S تومور بطور همزمان اندازه گیری می شود.تومورهای با فاز Sکوتاهتر (کمتر از 4/4% برای تومورهای دیپلوئید و کمتر از 7% برای تومورهای آناپلوئید) میزان زنده ماندن 5 ساله بهتربدون بیماری نسبت به بیماران با فازS طولانی تر داشتند. احتمال عود در بیمارانی که فاز S طولانی و بیماری میکرومتاستاتیک دارند بسیار بیشتراست.
درمان کمکی (Adjuvant therapy)
فاکتورهای بسیاری برپیش آگهی بیماری و تصمیم درجهت توصیه به درمان کمکی تاثیر دارد.این فاکتورها شامل اندازه تومور، وضعیت گره های لنفاوی،بافت شناسی، وضعیت یائسگی و سن،درجه تومور (grade)،وضعیت ER،پیشرفت سریع یا کند درمان های قبلی و شواهد بیماری متاستاتیک است.درنیمی ازبیماران،انجام درمان کمکی اجتناب ناپذیرو کاملاً مشخص است.درحدود 25% بیماران که تومورهای کوچکتر از 1 سانتیمتر داشته و بافت شناسی مطلوبی دارند نباید درمان کمکی دریافت دارند.25% باقی مانده که دارای تومور بزرگ با پروگنوز بد می باشند عمدتاً باید درمان کمکی دریافت کنند.50% دیگر بیماران کاندید درمان کمکی ازتوموربا اندازه متوسط برخوردارند.
مطالعات مختلفی نشان می دهد که مرگ و میر (Mortality) با درمان کمکی در زنان یائسه یا غیریائسه تا حداقل 20% کاهش می یابد. در یک مطالعه،کموتراپی سیستمیک کمکی میزان مرگ ناشی از سرطان پستان را تا 25% از 10 سال اول بعد از تشخیص کاهش داد.درمان کمکی در گروه های پرخطر باعث تشخیص کاهش داد.درمان کمکی در گروه های پرخطر باعث کاهش وضح در میزان عود و مرگ و میر ناشی از بیماری می شود.پلی کموتراپی در زنان یائسه و غیر یائسه باعث بهترشدن نتیجه درمانی می شود ولی این نتیجه در زنان یائسه بارزتراست.مصرف تاموکسی فنی ستیرات (Nolvadex ) در زنان یائسه در مقایسه با زنان غیر یائسه به ویژه کسانی که گیرنده استروژن مثبت (+ER) هستند باعث بهبودی قابل توجه ای می شود.در بعضی مطالعات نشان داده شده که آندوکموتراپی برای بیماران یائسه بویژه زنان ER منفی با خطر بالای عود مفید می باشد.ارزیابی خطر طبی درتصمیم به اینکه کدام بیماریائسه باید تحت کموتراپی قرار گیرد لازم است.
توصیه می شود که درمان کمکی در تمام زنان غیر یائسه که از نظر گره لنفاوی منفی هستند و اندازه تومور از 1 سانتیمتر بزرگتراست تجویزشود.تاموکسی فن ممکن است برای تمام زنان یائسه که گره لنفاوی مثبت یا منفی با توموربزرگتراز 1 سانتیمتر دارند مفید باشد.اگراین بیمارانی ER منفی هستند آنالیزخطر-فایده (Risk - Benefit) هدایت گر تاموکسی فن به رژیم کموتراپی مورد بحث است.برای زنان یائسه،وضعیت پروتئین ER درانتخاب درمان بسیارمهم است.
ترکیبات کموتراپی مختلفی در دسترس قرار دارند.داروها و ترکیبات زیر درمان استفاده شده اند:سیکلوفسفامید،متوتروکسات و فلوئورو اوراسیل (CMR) - سیکلوفسفامید،دوکسوروبیسین (آدریاماسین) و فلوئورو اوراسیل (CAF)- فلوئورواوراسیل،دوکسوروبیسین و سیکلوفسفامید (CAF)- فلوئورو اوراسیل، دوکسوروبیسین و سیکلوفسفامید (FAC). داروی فعال دیگری که در سرطان پستان استفاده می شود پاکلی تاکسل (Taxol) می باشد.اضافه کردن تاموکسی فن باعث کاهش عود و مرگ ومیرمی شود ولی از آنجائی که باعث افزایش خطر سرطان آندومتر می شود در مصرف آن باید احتیاط نمود.
بیماران در مطالعه NSABP B14 با قرص های 20 میلی گرم تاموکسی فن و پلاسبو تحت درمان قرار گرفتند.با مصرف تاموکسی فن خطر سرطان آندومتر به حدود 2 مورد در هر 1000 مورد افزایش یافت. بیمارانی که با تاموکسی فن درمان می شوند باید بطور سالیانه تحت معاینه ژنیکولوژی قرار گیرند و درصورت هرگونه خونریزی واژینال در زنان یائسه حتماً باید بررسی دقیق تر انجام گیرد. نقش اولتراسونوگرافی داخل واژن و بیوپسی راندوم آندومتر مشخص نبوده و مطالعه بیشتری را می طلبد.اگرهیپرپلازی تیپیک آندومترایجاد گردد،تاموکسی فن باید قطع شود و هیسترکتومی مد نظرقرارگیرد.
رادیوتراپی کمکی آگزیلا بویژه به کسانی توصیه می شود که بیش از 3 غده لنفاوی درگیر دراثرتومور یا گسترش خارج کپسولی لنف نود دارند.بیمارانی با گره های لنفاوی متعدد (10 عدد یا بیشتر) دارای خطر 70% عود در طول 10 سال بوده و ممکن است علاقه مند به استفاده از پروتکل های بیمارستانی با استفاده ازدوزبالای کموتراپی با حفاظت از مغزاستخوان و سلول های ریشه ای خون محیطی باشند. عوارض این درمان شامل ادم بازو، فیبروز و محدودیت حرکتی
است.رادیوتراپی آگزیلا باعث کنترل واضح بیماری های ناحیه ای شده و بیماران باید مزایا را نسبت به خطرات ارزیابی کنند.
پیگیری (Follow up)
بیماران با سابقه سرطان پستان باید هم در مورد عودهای موضعی - ناحیه ای و هم سرطان ثانویه پستان مورد ارزیابی قرار گیرند.ماموگرافی باید بطورمعمول در پستان غیر درگیر بطور سالیانه انجام گیرد.اگر عمل حفظ پستان غیردرگیر بطورسالیانه انجام گیرد.اگرعمل حفظ پستان انجام شده است توصیه می شود که هر 6 ماه بمدت 5 سال پستان درگیرمورد آزمون غربالگری قرار گیرد. بعد از این زمان، معاینات سالیانه شامل شرح حال،معاینه فیزیکی و ماموگرافی کافی خواهد بود.خطر عود از حدود 2% تا 5% در هر سال از سال 2 تا 6 به 1% در سال بعد از این مدت کاهش می یابد. تستهای بسیاری مانند شاخص های توموری در دسترس پزشکان برای پیگیری وجود دارد با این حال مقایسه این نوع پیگیری دقیق با پیگیری روتین بدون این تست ها هیچ تفاوتی را نشان نمی دهد.
ژنتیک -سابقه فامیلی
گستره ژنتیک و سابقه فامیلی یک روند جدید در آینده است.آزمون ژنتیکی برای بررسی استعداد به سرطان ارثی نقش بسیار مهم و رو به افزایشی در تامین سلامتی ایفا می کند. وقتی که سرطان پستان در یک فرد تشخیص داده می شود،بیمارسابقه فامیلی خود را مرورمی کند.سایراعضای فامیل نیز به موضوع بیماری توجه کرده و در مورد استعداد ارثی این بیماری سؤال می کنند. باید سعی شود زنانی که در ژن های سرطان پستان موتاسیون دارند و احتمال بروز بیماری در اعضای فامیل بسیار بالا است،شناسائی شوند.یافتن ژن های جدید سرطان پستان مانند BRCA1 و BRCA2 باعث شده است که آزمون های ژنتیکی برای بررسی استعداد سرطان پستان و تخمدان بصورت تجاری در دسترس قرار گیرد. در حال حاضر کاربرد کلینیکی این اطلاعات مشخص نیست.
عوامل خطری که برای تعیین احتمال ابتلاء فردی که حامل ژن های BRCA1 و BRCA2 است،درنظر گرفته می شود. سن در زمان تشخیص سرطان پستان یا تخمدان،تعداد و سن منسوبین درجه یک و دو در زمان تشخیص سرطان پستان یا تخمدان و در آنها وقوع تومورهای همراه (مانند سرطان پروستات) درهمان منسوبین و وضعیت نژادی است.بهترین فردی که می تواند مورد بررسی قرار گیرد کسی است که دچار سرطان است.توضیح انجمن آمریکائی انکولوژی بالینی در مورد وجود احتمال بالای موتاسیون (بیش از 10%) در BRCA1 به شرح زیر است:
* خانواده ای که دو یا بیشتر موردسرطان پستان در آن رخ داده یا اینکه یک مورد یا بیشتر سرطان تخمدان تشخیص داده شده و در هرسنی در آن وجود دارد.
* خانواده ای که سه مورد یا بیشتر سرطان پستان و دو مورد سرطان تخمدان یا یک سرطان پستان و یک سرطان تخمدان وجود داشته و قبل از 50 سالگی تشخیص داده شده است.
* خانمی که در خانواده او دو مورد سرطان پستان و دو مورد سرطان تخمدان یا یک سرطان پستان و یک سرطان تخمدان وجود داشته و قبل از 50 سالگی تشخیص داده شده است.
آزمون های ژنتیکی برای بررسی میزان استعداد ارثی به سرطان باعث تاثیر بر سلامت فردی،فیزیولوژیک،احتماعی، اقتصادی و اخلاقی می شود.مزایای این آزمون ها هنوز روشن نشده است.کسانی که برای آزمون ژنتیکی انتخاب می شوند باید آموزش های لازم را دریافت کرده و قبل از آزمون با آنها مشاوره انجام شود. در این حالت بیماران قادر به تصمیم گیری در مورد انجام دادن یا ندادن تست خواهند بود.با تکمیل آزمون ژنتیکی،مراقبت های مشاوره ای و پیگیری باید انجام گردد.این بیماران باید از این موضوع که روش اثبات شده خاصی در پیشگیری از خطر بروز سرطان در کسی که ژن موتاسیون یافته را به همراه دارد وجود ندارد،آماده گردد.
داده های رتروسپکتیو در یک مقاله اخیر از Mayo Clinic کاهش 91% در سرطان پستان در 2500 نفر افراد پر خطر (high- risk) که جراحی پروفیلاکتیک در این مرکز برروی آنها انجام شد را نشان می دهد.ماستکتومی پروفیلاکتیت یک گزینه برای زنانی است که استعداد ژنتیکی به سرطان پستان دارند.ماستکتومی توتال از ماستکتومی پروفیلاکتیک یک گزینه برای زنانی است که استعداد ژنتیکی به سرطان پستان دارند.ماستکتومی توتال از ماستکتومی زیرجلدی موثرتراست.ازمیان جمعیتی که وقوع 76 مورد سرطان مورد انتظار بود فقط 9 مورد سرطان اتفاق افتاد. کارآزمائی های Chemopreventive نوید بخش درمان در سالهای آتی هستند. هیچ داده ای در تعیین اینکه میزان کاهش خطر در زنانی که دچار موتاسیون BRCA1 و BRCA2 می باشند وجود ندارد.
کسانی که نتیجه تست ژنتیکی آنها منفی بوده است نیزمی توانند بر مبنای سن، محیط و سایر فاکتورهای ژنتیکی یا
موتاسیون های ناشناخته درمعرض خطر باشند.به این افراد نیز باید توصیه به غربالگری سالیانه برای سرطان نمود. آزمون استعداد ژنتیکی مقوله پیچیده ای است.پزشکان باید متخصصان با تجربه را برای مشاوره ژنتیک و آزمون های لازم برای کسانی که تمایل به انجام این آزمون ها دارند را شناسایی نمایند.
نتیجه گیری
امروزه سرطان پستان در مراحل اولیه تشخیص داده می شود و متخصصین زنان و زایمان در بهترین موقعیت از نظر تشخیص زودرس از طریق تکنیک های غربالگری و انجام معاینات دقیق قرار دارند.کالج آمریکائیی متخصصان زنان و زایمان (ACOG) غربالگری برای سرطان پستان را توصیه نمود و آموزش تمام متخصصان زنان زایمان را در تشخیص و درمان بیماری های خوش خیم پستان و کاهش مرگ و میر ناشی ازسرطان را به عنوان هدف پذیرفته است.برای رسیدن به این اهداف متخصصان زنان و زایمان باید بدانند که :
1- معاینه پستان،لمس (palpation) و مشاهده (inspection) دو بخش مهم معاینه بالینی کامل محسوب می شوند.
2- به بیماران باید برای معاینه پستان آموزش تمام عمر داده شود.
3- تمام زنان را تشویق به انجام ماموگرافی غربالگری نمایند.
جامعه سرطان آمریکا (The American Cancer Society) امروز ماموگرافی سالیانه را از 40 سالگی توصیه می کند. در صورتیکه در منسوبین درجه یک یا در خود آنها سابقه سرطان وجود دارد.این تست باید زودتر انجام گیرد.
زنانی که دچارسمپتوم های مربوط به پستان می باشند باید مورد بررسی قرارگیرند. مرحله اول دراین بررسی تشخیص توده غالب (dominant mass) ناشی از FCC است.اگریک توده جدا و قابل لمس میباشد آسپیراسیون برای تعیین توپربودن (solid) یا کیست بودن آن باید انجام گیرد. در صورتی که این ضایعه توپر (solid) باشد،سرطان پستان باید رد شود. FNA یک مرحله میانی در تشخیص سرطان پستان است ولی درهرحال اغلب بیماران نیاز به تائید بافت شنای بدنبال بیوپسی پستان دارند. متخصص زنان و زایمان باید مسئولیت معرفی کردن بیمار به پزشک متخصص سرطان را پس ازانجام مراحل تشخیصی اولیه بر عهده گیرد.ماموگرافی و یا اولتراسونوگرافی تشخیصی در زنان علامت دار،لازم است.هنگامی که ارجاع بیمار ضروری می شود بر مبنای توصیه ACOG متخصص زنان - زایمان باید علاوه برتوضیحات لازم در مورد لزوم انجام مراقبت های بیشتر و ارائه اسامی پزشکان متبحربه سوالات بیمار نیز پاسخ دهد.
بعلاوه ACOG تحقیقات پایه و بالینی را در ارتباط با تشخیص زودرس و درمان کلیه بیماری های پستان مورد تشویق قرار می دهد.این مطلب باید توسط برنامه های آموزش رزیدنتی و تحصیلات تکمیلی پزشکی انجام شود.این بخش،آموزش تشخیص زودرس و گزینه های درمانی را شامل می شود.
بیشتر سرطان های پستان در مراحل I و II با توجه به پیشرفت مودالیته های غربالگری تشخیص داده می شوند. عمل حفظ پستان (لامپکتومی همراه با تشریح غدد لنفاوی زیر بغلی)ازنظر میزان برزیستی (Survival rate)معادل رادیکال ماستکوتومی تعدیل شده اند.انستیتو ملی سلامتی (National Institute of Health) توصیه بر انجام روش حفظ پستان در مواردی که قابل انجام باشد می نماید.رادیوتراپی پستان هنگامی که این عمل انتخاب می شود،توصیه می گردد.
نشان داده شده است که شیمی درمانی کمکی یا درمان هورمونی باعث کاهش میزان عود و بهبودی میزان زندگی در بیمارانی که توموری با قطر بیش از 1cm یا گره لنفاوی مثبت دارند شده است.تکنیک های جدید تشخیصی مانند CNG استرئوتاکتیک و نقشه برداری لنفاوی از گره نگهبان درحال تلفیق با اعمال طبی است.این روش ها به گونه ای طراحی شده اند که کمترمهاجم بوده و در ضمن، اطلاعات طبی مورد نیاز را بدست دهند. درحال حاضربعلت اینکه یادگیری این روشهای نیازبه آموزش بیشتردارد لذا انجام این روش ها نیاز به افراد ماهر ویژه دارد ولی انتظار می رود که درآینده نه چندان دوری این روش ها بصورت یک عمل استاندارد در آیند.
متخصصین زنان -زایمان در مرحله اول تشخیص سرطان پستان قرار دارند.این پزشکان باید ازتمام فرصت ها برای درمان بیماران درمراحل اول استفاده نمایند.ازتمام آنها دعوت به ایفای نقش در غربالگری سرطان پستان و درصورت نیاز درمان می شود.
منبع:نشریه مامایی و بیماریهای زنان دنفورث(جلد دوم)
/ج