فرادید؛ پژوهشگران دانشکدهی پزشکی استنفورد گزارش میدهند که مهار یک پروتئین وابسته به پیری میتواند غضروفی را که بهشکل طبیعی در زانوی موشهای مسن تحلیل میرود، بازسازی کند. در این مطالعه، درمان تزریقی نهتنها غضروف را دوباره ساخت، بلکه پس از آسیبهای زانو نانند پارگی رباط صلیبی قدامی (ACL) که در ورزشکاران و بزرگسالان فعال شایع است، از بروز آرتروز هم جلوگیری کرد. نسخهی خوراکی همین درمان هماکنون در کارآزماییهای بالینی با هدف درمان ضعف عضلانی مرتبط با افزایش سن در حال آزمایش است.
به گزارش فرادید، بافت زانوی انسان که در جریان جراحیهای تعویض مفصل جمعآوری شده بود هم به این درمان پاسخ مثبت نشان داد. این نمونهها که هم داربست خارجسلولیِ پشتیبان مفصل (ماتریکس) و هم سلولهای تولیدکنندهی غضروف (کندروسیتها) را شامل میشوند، شروع به تشکیل غضروف جدیدی کردند که عملکرد طبیعی داشت.
در مجموع، این یافتهها نشان میدهند که شاید در آینده بتوان غضروف از دسترفته بر اثر پیری یا آرتروز را با تزریق موضعی یا داروی خوراکی بازسازی کرد و بهطور بالقوه نیاز به جراحی تعویض زانو یا لگن را از میان برداشت.
هدفگیری ریشهی آرتروز
این درمان بهجای تسکین نشانهها، عامل زمینهای آرتروز را هدف میگیرد. این بیماری حادشونده مفصلی حدود یکپنجم بزرگسالان ایالات متحده را درگیر میکند و سالانه حدود 65 میلیارد دلار هزینهی مستقیم مراقبتهای سلامت ایجاد میکند. در حال حاضر هیچ دارویی وجود ندارد که بتواند روند بیماری را متوقف یا معکوس کند و مدیریت درد و تعویض مفصل گزینههای اصلی درمان هستند.
این درمان پروتئینی به نام 15-PGDH را هدف میگیرد که با افزایش سن فراوانتر میشود و در ردهی «جروزایمها» (gerozymes) قرار میگیرد. جروزایمها که نخستینبار سال 2023 توسط همین گروه پژوهشی توصیف شدند، نقش محوری در پیری دارند و به افت تدریجی عملکرد بافتها کمک میکنند. در موشها، افزایش سطح 15-PGDH عامل کلیدی کاهش قدرت عضلانی مرتبط با سن است. هنگامی که دانشمندان این پروتئین را با یک مولکول کوچک مهار میکنند، موشهای مسن افزایش تودهی عضلانی و استقامت نشان میدهند. در مقابل، واداشتن موشهای جوان به تولید 15-PGDH سبب ضعف و تحلیل عضلات آنها میشود. این پروتئین همچنین با بازسازی سلولهای استخوانی، عصبی و خونی مرتبط دانسته شده است.
در آن بافتها، ترمیم به فعالسازی و تمایز سلولهای بنیادی اختصاصی بافت وابسته است. اما غضروف رفتار متفاوتی دارد. بهجای اتکا به سلولهای بنیادی، کندروسیتها فعالیت ژنی خود را بهگونهای تغییر میدهند که حالت جوانتری را بازمییابد و بازسازی بدون دخالت سلولهای بنیادی رخ میدهد.
هلن بلو، دکترای میکروبیولوژی و ایمنیشناسی گفته: «این یک روش جدید برای بازسازی بافت بالغ است و نوید بالینی قابلتوجهی برای درمان آرتروز ناشی از پیری یا آسیب دارد. ما بهدنبال سلولهای بنیادی بودیم، اما بهوضوح دخالتی ندارند. این بسیار هیجانانگیز است.»
بوتانی گفته: «میلیونها نفر با افزایش سن از درد و تورم مفاصل رنج میبرند. این یک نیاز درمانی بزرگ و برآوردهنشده است. تا به امروز هیچ دارویی وجود نداشت که مستقیم دلیل از دست رفتن غضروف را درمان کند. اما این مهارکنندهی گروزایم سبب بازسازی چشمگیر غضروف شده؛ فراتر از آنچه در پاسخ به هر دارو یا مداخلهی دیگری گزارش شده.»
سه نوع اصلی غضروف در بدن انسان وجود دارد. غضروف الاستیک نرم و انعطافپذیر است و ساختارهایی مانند لالهی گوش را تشکیل میدهد. غضروف فیبری (فیبروغضروف) متراکم و سخت است و ضربه را در نواحی مانند بین مهرههای ستون فقرات جذب میکند. نوع سوم، غضروف هیالین، صاف و براق است و سطحی کماصطکاک برای روانسازی و انعطافپذیری مفاصل مانند مچ پا، لگن، شانه و بخشهایی از زانو فراهم میکند. غضروف هیالین که به آن غضروف مفصلی هم گفته میشود، بیشترین درگیری را در آرتروز دارد.
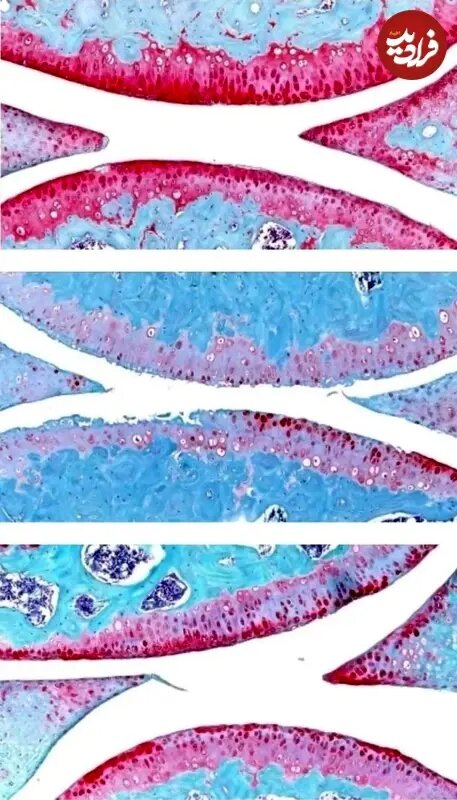
مفصل زانوی یک موش جوان (بالا)، موش مسن (میانه) و موش مسنِ درمانشده (پایین). رنگ قرمز نشاندهندهی غضروف است
آرتروز زمانی رخ میدهد که مفصل بر اثر پیری، آسیب یا چاقی تحت فشار قرار گیرد. کندروسیتها شروع به آزادسازی مولکولهای پیشالتهابی و تجزیهی کلاژن (پروتئین ساختاری اصلی غضروف) میکنند. با از دست رفتن کلاژن، غضروف نازک و نرم میشود و التهاب همراه، تورم و درد مفصل را (که از ویژگیهای بارز بیماری است) ایجاد میکند. در شرایط عادی، غضروف مفصلی بهندرت بازسازی میشود. اگرچه برخی جمعیتهای فرضی از سلولهای بنیادی یا پیشسازِ قادر به تولید غضروف در استخوان شناسایی شدهاند، تلاشها برای یافتن جمعیتهای مشابه در غضروف مفصلی موفقیتآمیز نبوده است.
پژوهشهای پیشین آزمایشگاه بلو نشان داده بود مولکولی به نام پروستاگلاندین E2 برای عملکرد سلولهای بنیادی عضله ضروری است. 15-PGDH پروستاگلاندین E2 را تجزیه میکند. مهار فعالیت 15-PGDH یا افزایش سطح پروستاگلاندین E2 از بازسازی عضله، عصب، استخوان، کولون، کبد و سلولهای خونی آسیبدیده در موشهای جوان پشتیبانی میکند.
بلو، بوتانی و همکارانشان بررسی کردند که آیا 15-PGDH در پیری غضروف و مفاصل هم نقش دارد یا خیر و آیا مسیر مشابهی در از دست رفتن غضروف بر اثر پیری یا در پاسخ به آسیب دخیل است. مقایسهی میزان 15-PGDH در غضروف زانوی موشهای جوان و پیر نشان داد که همانند سایر بافتها، سطح این گروزایم با افزایش سن حدود دو برابر میشود.
سپس آنها با تزریق یک داروی مولکول کوچکِ مهارکنندهی 15-PGDH به حیوانات پیر (ابتدا به داخل شکم با اثر سیستمیک و سپس مستقیما به مفصل) آزمایش کردند. در هر دو حالت، غضروف زانو که در حیوانات مسن نسبت به موشهای جوان بهطور محسوسی نازکتر و کمکارتر بود، در سراسر سطح مفصل ضخیمتر شد. آزمایشهای تکمیلی تأیید کرد که کندروسیتهای مفصل در حال تولید غضروف هیالین (مفصلی) هستند، نه فیبروغضروفِ کمکارتر.
بوتانی درباره این آزمایش گفته: «بازسازی غضروف تا این حد در موشهای مسن ما را شگفتزده کرد. اثر آن چشمگیر بود.»
پرداختن به پارگیهای ACL
نتایج مشابهی در حیوانات دارای آسیبهای زانو مانند پارگی ACL که در ورزشهایی چون فوتبال، بسکتبال و اسکی با چرخشهای ناگهانی، توقف یا پرش رخ میدهد، مشاهده شد. اگرچه این پارگیها قابلترمیم با جراحی هستند، حدود 50٪ افراد طی حدود 15 سال در مفصل آسیبدیده دچار آرتروز میشوند.
پژوهشگران دریافتند مجموعهای از تزریقها، دو بار در هفته به مدت چهار هفته پس از آسیب، از مهارکنندهی گروزایم به شکل چشمگیری احتمال بروز آرتروز در موشها را کاهش میدهد. حیواناتی که داروی کنترل دریافت کرده بودند، سطح 15-PGDH آنها دو برابر همتایان بدون آسیب بود و ظرف چهار هفته به آرتروز مبتلا شدند.
حیواناتِ درمانشده با مهارکنندهی گروزایم همچنین الگوی حرکتی طبیعیتری داشتند و وزن بیشتری را روی پنجهی پای آسیبدیده میگذاشتند.
بلو گفته: «جالب اینجاست که پروستاگلاندین E2 با التهاب و درد مرتبط دانسته شده، اما این پژوهش نشان میدهد در سطوح زیستی طبیعی، افزایشهای کوچک پروستاگلاندین E2 میتواند بازسازی را تقویت کند.»
بررسی دقیقتر کندروسیتها در مفاصل موشهای پیر و جوان نشان داد که کندروسیتهای پیر بیان ژنهای مضرِ بیشتری مرتبط با التهاب و تبدیل غضروف هیالین به استخوان ناخواسته دارند و در مقابل، ژنهای کمتری مرتبط با تکوین غضروف بیان میکنند.
برنامهریزی مجدد سلولهای غضروف بدون سلولهای بنیادی
پژوهشگران همچنین توانستند زیرگروههایی از کندروسیتهای پیر را شناسایی کنند که پس از درمان الگوی بیان ژن آنها تغییر میکند. یکی از این زیرگروهها که 15-PGDH و ژنهای دخیل در تخریب غضروف را بیان میکند، پس از درمان از 8٪ به 3٪ کاهش یافت. زیرگروه دیگری که 15-PGDH را بیان نمیکند اما ژنهای تولید فیبروغضروف را بیان میکند هم از 16٪ به 8٪ کاهش یافت.
در مقابل، جمعیت سومی که 15-PGDH تولید نمیکند و ژنهای دخیل در تشکیل غضروف هیالین و حفظ ماتریکس خارجسلولیِ لازم برای عملکرد آن را بیان میکند، پس از درمان از 22٪ به 42٪ افزایش یافت. این یافتهها گواه یک جابهجایی کلی در بیان ژنها به سوی ترکیب غضروفی جوانتر است، بدون دخالت سلولهای بنیادی یا پیشساز.
در نهایت، پژوهشگران بافت غضروف انسانیِ برداشتهشده از بیماران مبتلا به آرتروز که تحت تعویض کامل زانو قرار داشتند را بررسی کردند. بافتی که مدت یک هفته با مهارکنندهی 15-PGDH تیمار شده بود، نسبت به بافت کنترل، سطوح پایینتری از کندروسیتهای بیانکنندهی 15-PGDH و کاهش ژنهای تخریب غضروف و فیبروغضروف نشان داد و شروع به بازسازی غضروف مفصلی کرد.
بوتانی گفته: «این سازوکار بسیار چشمگیر است و به راستی دیدگاه ما را دربارهی چگونگی وقوع بازسازی بافت تغییر داد. روشن است که مخزن بزرگی از سلولهای ازپیشموجود در غضروف در حال تغییر الگوهای بیان ژنی خود هستند. با هدفگیری این سلولها برای بازسازی، ممکن است از دید بالینی اثر کلی بزرگتری ایجاد کنیم.»
بلو افزود: «کارآزماییهای بالینی فاز 1 مهارکنندهی 15-PGDH برای ضعف عضلانی نشان دادهاند که این دارو در داوطلبان سالم ایمن و فعال است. امید ما اینست که بهزودی کارآزمایی مشابهی برای سنجش اثر آن در بازسازی غضروف آغاز شود. ما از این دستاورد بالقوه بسیار هیجانزدهایم. تصور کنید غضروف موجود دوباره رشد کند و از تعویض مفصل اجتناب شود.»
مترجم: زهرا ذوالقدر