نازایی و روش های کمکی درمان آن
Infertility and Assisted Reproduation
اصطلاحات مبحث باروری انسان هنوز با ابهاماتی مواجه است.عدم وضوح چنین اصطلاحاتی ارزیابی امکانات تشخیصی و درمانی نازایی برای بیماران و پزشکان را مشکل نموده است. خیلی از افراد اصطلاح نازایی (infertility) بطرق مختلف استفاده می کنند که اغلب با ارتباط صحیح آن تداخل دارد.جدول 1به تعریف این اصطلاحات اختصاص دارد.
عملاً در یک زوج با باروری طبیعی در طی یکسال با نزدیکی منظم،اگراز روشهای جلوگیری استفاده نکنند،حاملگی رخ خواهد داد. اگر در طی یکسال حاملگی صورت نگیرد اصطلاح نازایی در مورد آن زوج اطلاق می گردد،مگراثبات شود که حاملگی غیر ممکن است که در آن صورت اصطلاح عقیمی بکار خواهد رفت.
احتمال حاملگی در هرسیکل یکی ازراههای معنی دار ارزیابی زوج ها و توصیه درمانهای اختصاصی به آنها می باشد که معمولاً تحت عنوان cycle fecundity یا fecundability نامیده می شود. میزان باروری در هر سیکل اگر چه در جمعیت اندازه گیری می شود (population - based measure)، رایج ترین پارامترقابل استفاده در تصمیم گیری مراقبتهای زوج نازاست.
درآمریکا حدود 2/5 میلیون زوج نازا وجود دارد.تعداد زوجهای نازا و بطور کلی میزان وقوع نازائی در آمریکا تغییر واضحی در چند دهه گذشته نداشته،اگرچه بوضوح تعداد مطب پزشکانی که مراجعین دچار نازایی را ویزیت می کنند دراین فاصله افزایش داشته است.فاکتورهای احتمالی در افزایش تقاضا برای درمان نازایی زیاد است اما بنظر می رسد با افزایش مشکلات،تاخیردربچه دار شدن،توقعات افراد در سنین باروری، کاهش تعداد نوزادان برای فرزند خواندگی (adoption)،پیشرفت های قابل توجه در تکنولوژی تولید مثل و افزایش پذیرش جامعه در حل مشکلات نازایی در
جدول1 :تعریف اصطلاحات مورد استفاده در نازایی
|
اصطلاح
|
تعریف لغوی
|
تعریف عملی
|
|
(زایا)(زایایی)
|
قابلیت حاملگی و بچه دار شدن
|
حاملگی خودبخود در کمتر از یکسال *که معمولاً تا پس از سه ماهه ی اول ادامه می یابد و ممکن است به زایمان نوزاد زنده منجر شود.
|
|
(عقیم)/(عقیمی)
|
عدم حاملگی
|
عدم توانایی در باروری(حاملگی)
|
|
(نازا)/(نازایی)
|
کاهش یا عدم باروری که غیر قابل برگشت نمی باشد.
|
حاملگی در طی یکسال یا بیشتر صورت نگیرد.
|
|
(بارور)/(باروری)
|
زایایی مشخص ،قابلیت تکرار باروری یا تلقیح
|
احتمال بوجود آمدن حاملگی در هر سیکل
قابلیت باروری در هر سیکل
|
|
(چندزا)/چندزایی)
|
بچه های زیادی بدنیا آوردن
|
تعداد جنین ها یا نوزادان زنده در هر حاملگی
|
*-بفرض اینکه زوجین جلوگیری نداشته باشند.
ارتباط است.یک فاکتورقابل اندازه گیری که بوضوح در باروری نقش دارد سن مادر می باشد.،سن ازدواج و میزان باروری درکسانی که جلوگیری نداشته اند بطور قابل توجهی بعد از 35 سال کاهش می یابد و در سالهای قبل از یائسگی به صفر می رسد (برای مثال در پنجاه سالگی).بیشتراین کاهش می تواند مربوط به تغییر در تخمک گذاری باشد.تاخیر در بچه دار شدن نیز باعث افزایش ایجاد آندومتریوز و صدمات ناشی از آن نظیر انسداد لوله و چسبندگی لگن در اثر عفونتهای لگن می گردد.هیچیک از این گروههای تشخیصی جدید نیست،اما وقوع نسبی تشخیص های متفاوت کاملاً نسبت به دهه های گذشته تغییر کرده که بدلیل فاکتورهای اجتماعی است.
ارزیابی
بررسی و ارزیابی تشخیصی نازایی در انسان به راحتی می تواند در مسیر عبور اسپرم در دستگاه تناسلی تا محل لقاح و سپس لانه گزینی باشد.این طریق بررسی شاید از نظرتفهیم بیولوژیک مناسب باشد ولی معرف یک بررسی عملی و کافی نیست.شاید بتوان بطریقی دیگر گروههای نازایی را بوسیله تستهای تشخیصی تعریف نمود در این زمینه سه گروه فاکتور وجود دارد:
* فاکتور گامت مرد
* فاکتورگامت زن
* فاکتورهای دستگاه تناسلی زن
این مفاهیم راحت و مطابق با طبیعت تست های تشخیص در دسترس بوده و توضیح آن برای بیمارآسان است.
تشخیص و درمان
فاکتور گامت مرد
اگر در مرد اسپرم تولید نشود،تشخیص آزوسپرمی است و عقیمی به حساب فاکتور مرد گذاشته می شود.نارسایی در اسپرماتوژنز که نتیجه کاهش تعداد،تحریک یا قابلیت تلقیح اسپرم می باشد از نظر تعریف دشوارتراست.خصوصیات زیادی در نتایج آنالیز مایع منی وجود دارد که در راستای افتراق مرد زایا از نازااست،اما این کوشش ها با توجه به تعداد کم اسپرمها در بعضی از مردان زایا و متغیر بودن شمارش دردان طبیعی،بی نتیجه به نظر می رسند.در جدول 2 فهرست پارامترهایی که در تجزیه مایع منی استاندارد وجود دارد آورده شده است.اگر درآنالیز مایع منی معیارها ازنظر شمارش و تحرک کمتر از این مقادیرباشد،ارزیابی های بعدی شریک جنسی مرد لازم است اگرچه بعضی مردان در این گروه نیز زایا هستند.
جدول 2 :تجزیه استاندارد منی (Semen)
|
پارامتر
|
مقادیر متوسط
|
|
قوام
|
مایع (بعد از لیکنیفیکاسیون )
|
|
رنگ
|
اپاک
|
|
زمان لیکنیفیکاسیون
|
20 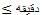
|
|
pH
|
8/7-2/7
|
|
حجم
|
6-2میلی متر
|
|
تحرک (درجات 4-0)
|
50 0/0 
|
|
شمارش (میلیون /میلی لیتر)
|
100-20
|
|
زنده بودن (ائوزین)
|
50 0/0 
|
|
مورفولوژی (سیتولوژی)انواع سلول ها
|
60 0/0 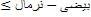
|
|
(سلولها )(سلول های خونی سفید ،سایرین)
|
هیچ تا گاهگاهی
|
|
اگلوتیناسیون
|
هیچ
|
|
مطالعات بیوشیمی (یعنی فروکتوز ،پروستاگلندین ها،روی )در صورت امکان
|
|
شرح ارزیابی سیتمیک لازم ازعهده این بخش خارج است.بطورخلاصه نتایج تشخیصی از تکرارتست و طبیعی بودن آن تا اشکالات آندوکرین،انسداد آناتومیک در سیستم مرد و یا اشکال دراسپرماتوژنز متغیر است.ذکراین نکته اهیمیت دارد که با تکنولوژیهای جدیدتردر درمان نازایی (برای مثال تلقیح داخل سیتوپلاسمی اسپرم (ICSI (Intracytoplasmic injection of sperm حاملگیهایی صورت می گیرد که در سالهای قبل غیر ممکن بنظر می رسید بدلیل تعداد خیلی کم اسپرم ها و اشکالات تولید آن میزان وقوع مشکلات انزال که شامل فرمهای زیادی از آزوسپرمی و یا مشکلاتی جنسی (sexual) می باشد در جمعیت نازا دقیقاً مشخص نمی باشد ولی بعضی از زوجهای نازا از مشاوره با اورولوژیست و یا مشاوره روانی برای درمان مشکلات جنسی سود می برند.
فاکتور گامت زن
آزاد شدن دوره ای تخمک برای آبستنی لازم است و خانمهایی که بطور فیزیولوژیک تخمک گذاری ندارند مثل بچه ها قبل از بلوغ،زنان عقیم و زنان یائسه،عقیم می باشند.نازایی به دلیل مشکل تخمک گذاری در زنان سنین باروری مشکل تر تشخیص داده می شود.زیرا فاکتورارزیابی آن در
کلینیک،غیرمستقیم است.بعبارت دیگر اثبات قطعی تخمک گذاری با وجود آمدن آبستنی و یا مشاهده تخمک خارج از تخمدان به انجام می رسد.همه فاکتورهای دیگر غیر مستقیم بوده،شامل ریتم پریود،کنترل حرارت بدن (BBT)،تغییردرموکوس سرویکس،علائم سیستمیک،کیتهای تشخیص اوولاسیون، بیوپسی آندومتر،سطح پروژسترون سرم، پایش رشد و کلاپس فولیکول با سونوگرافی و مقاومت الکتریکی واژینال و دهانی هستند.درنتیجه،همه این تستها می توانند دارای نتایج مثبت کاذب و یا منفی کاذب باشند.
بنابراین اهمیت کلینیکی وضعیتی که در آن تخمک گذاری طبیعی ولی بندرت اتفاق می افتد،(بعبارت دیگر اولیگواولاسیون) و یا سیکلهای تخمدانی غیرطبیعی (بعبارت دیگر اختلالات اوولاسیون) بعنوان یک نقطه مجادله درامرتشخیص بین صاحبنظران در مورد نازایی باقی مانده است.
اختلالات ظریف سیکل های تخمدانی می توانند عملاً با یکدیگر رخ دهند و تعریف آنها نیز مستقل ازیکدیگرنیست.اگرچه روشن نیست که خصوصیات دقیق سیکل های دیس فونکسیونل قبل از شروع درمان مستدل ضروری باشد ولی پیشرفت در درمان (ovulatory dystunction) بدلیل عدم وجود بررسی های دقیق و مطالعه زیر گروهای آن محدود شده است.
اسامی بیشماری دررابطه با اشکالات سیکلهای تخمدانی وجود دارد وکه شامل : سیکلهای بدون اوولاسیون،نقص فازلوتئال، اختلال فازلوتئال،کوتاه بودن فازلوتئال، اشکال در افزایش پروژسترون،سندرم فولیکول پاره نشده و اشکال در بلوغ فولیکول قبل ازتخمک گذاری از این جمله اند.اگرچه مطالعه وسیع آینده نگری در انسان که خصوصیات و میزان وقوع این اشکالات را نشان دهد صورت نگرفته ولی در حیوانات مثل میمون رزوس و گوسفند در چنین سیکلهای غیر طبیعی کاهش واضح باروری نشان داده شده است.
بنابراین تستهای تشخیصی زیادی برای تشخیص فعالیت تخمدان در دست است. تاریخچه فواصل عادات
ماهیانه بیمار پارامتر خونی برای تشخیص anovulation از سیکل های طبیعی یا غیر طبیعی تخمدانی است.حتی اگربیمار دارای سیکلهای منظم با فواصل طبیعی 2+28 روز باشد تستهای دیگری برای تشخیص سیکل های طبیعی تخمدانی از سیکلهای غیرطبیعی لازم است.
چارتهای BBT نرمال باشد می تواند اطمینان بیشتری ایجاد کند اما اگر بطور واضحی تغییر حرارت را در وسط سیکل همراه با یک فاز لوتئال مناسب 2+12 روزه،نشان ندهد تفسیر آن مشکل خواهد بود.بطورکلی اگر چارت BBT نرمال بنظر برسد پزشک می تواند اطمینان بیشتری پیدا کند ولی اثبات اوولاسیون با تست دیگری ازجمله سرم پروژسترون و یا بیوپسی آندومتر لازم است،اما اگرچارت کاملاً غیرطبیعی بنظر برسد یا تغییر مختصری داشته باشد مثل بالا رفتن آهسته درجه حرارت در وسط سیکل و یا فازلوتئال کوتاه باشد تستهای تشخیصی دیگری برای ارزیابی تخمک گذاری نرمال از نوع دیس فونکسیونل ضروری است.
بیوپسی آندومتر در ارزیابی تخمک گذاری بطور شایعی استفاده می شود و در ارزیابی اولیه این تست حدود 80 درصد دقت نسبت به فواصل سیکل،چارت BBT و سطح پروژسترون دارد.اندازه گیری مستقیم سطح پروژسترون سرم نیز ارزیابی شده سطح پروژسترون در وسط فاز لوتئال برای چرخه های طبیعی بیشتر از 15ng/ml باشد، بیشتر از 80% در تشخیص بین چرخه های طبیعی و غیر طبیعی صحت خواهد داشت.
اندازه بین 10 تا 15ng/ml اغلب هم در چرخه های طبیعی و هم غیر طبیعی دیده می شود ولی کمتر از 10ng/ml بندرت در سکیل طبیعی دیده می شود بخصوص اگرنمونه در ساعات صبح و در وسط فاز لوتئال گرفته شده باشد.پروفایل چرخه ای (Cycle profile) یک ارزیابی خوب و متقاعد کننده برای عملکرد تخمدان می باشد.این ارزیابی شامل آنالیزدقیق چرخه با نمونه گیری روزانه هورمونهای تولید مثل و سونوگرافی سریال با پایش رشد و کولاپس فولیکول است.
چنین رویکرد دقیقی به فونکسیون یک چرخه تخمدانی یک تست غربالگری عملی نبوده اما به صورت بالقوه استانداردی را به دست می دهد که می توان سایرتست ها را با آن مقایسه نمود.یک تست جدیدتر،اندازه گیری روزانه مقاومت الکتریکی واژن و بزاق است. بیماران به راحتی می توانند این تغییر مقاومت را قرائت نموده و ثبت کنند که بیشتر از 80% با شمای مانیتورینگ دقیق سیکل ارتباط دارد.به دلیل اینکه این تغییر مقاومت،اوولاسیون را در سیکل پیش گویی می کند بعنوان تستی که توسط بیمار قابل انجام است می تواند برای تعیین زمان نزدیکی مفید باشد.یک تست جدید دیگر که خود بیمار می تواند برای پیشگویی زمان اوولاسیون انجام دهد،تعیین منوکلونال آنتی بادی LH و استفاده از نمونه ادرار به روش immunosorbent colorimetric diptick است.تغییر رنگ نیمه کمی نشان می دهد که LH surge رخ داده است و بنابراین منتظر پدیده اوولاسیون خواهیم شد.تست مزبور در مشخص نمودن رویدادهای سکیل و بهبود زمان بندی نزدیکی به دلیل پیشگویی دقیق تر اوولاسیون (نسبت به چارت BBT) موثر و مفید است.ارتباط نتایج بدست آمده +822
با کیت LH کارخانه های مختلف می تواند متغیر باشد و تخمین دقت نیز متفاوت است. در صورت تخمین عدم تخمک گذاری، ارزیابی بیشتری برای افتراق مشکلات آندوکرینی که درکارایجاد اختلال می کنند از اختلالات اولیه تخمک گذاری لازم است. بیماریهای آندوکرین،متابولیک و سیستمیک زیادی در چرخه های طبیعی اختلال ایجاد می کنند اما فقط هیپرپرولاکتینمیا و هیپوتیروئیدیسم در حین ارزیابی نازایی بیشتر دیده می شوند.اگرچه بحث کامل در مورد ارزیابی و درمان هیپرپرولاکتینمیا و اختلالات تیروئید خارج از این بخش است، اما باید متذکر گردید که ،درمان اینها اغلب به برگشت عملکرد تخمدان به حالت طبیعی منجر می شود.

ازدیاد ایدیوپاتیک پرولاکتین
آدنوم هیپوفیز بعنوان یکی از علل هیپرپرولاکتینمی معمولاً خیلی خوب به برموکریپتین (Parlodel) ویا (Caberglide (Dostinex پاسخ می دهد.این آگونیست های قوی گیرنده های دوپامینرژیک مستقیماً قدامی کم می شود خواه آدنوم و یا میکروآدنوم وجود داشته باشد یا خیر،خیلی از بیماران با هیپرپرولاکتینومای متوسط آمنوره واقعی دارند ولی بعضی دیگر فقط تولید پروژسترون فاز لوتئال آنها کمترازطبیعی است.وقتی هیپرپرولاکتینوما علت عدم تخمک گذاری و یا اختلال تخمگ گذاری است، با طبیعی شدن پرولاکتین بعد از درمان دارویی عملکرد تخمدان در بیشتر بیماران بحالت طبیعی برمی گردد.
یکی از اختلالات وابسته به هیپرپرولاکتینمی،هیپوتیروئیدی اولیه است. وقتی هیپوتیروئیدی بطورکلینیکی ظاهر می شود مشکل تشخیصی وجود ندارد.اگر چه در بعضی بیماران تیروئید در سطح طبیعی است ولی سطح TSH بالاست که در جهت جبران اولیه هیپوتیروئیدیسم (Subclinical) رخ می دهد.درمان مناسب بیماران با افزایش خفیف TSH و پرولاکتین،جایگزینی هورمون تیروئید است که پاسخ به آن طبیعی شدن TSH و پرولاکتین و برگشتن سیکل تخمدان بحالب طبیعی را بدنبال دارد.سه گروه تشخیصی دیفونکسیون تخمدان وجود دارد،که ارتباطی با پرولاکتین و یا تیروئید ندارند.
گروه اول؛نارسایی تخمدان است که می تواند در هر سنی رخ دهد.بالا بودن سطح گنادوتروپین یافته معمول تست تشخیصی در این گروه است.درمان نازایی در این بیماران نیاز به تکنیک های نوین و اهدا تخمک دارد.
دومین گروه بیمارانی هستند که سطح پرولاکتین سرم طبیعی داشته و گنادوتروپین ها درآنها بالا نیست اما تقریباً هیپواستروژنیک هستند.این گروه را تحت عنوان آمنوره هیپوتالامیک می نامیم.عدم خونریزی با تزریق پروژسترون از نشانه های تشخیصی این گروه است.درواقع این بیماران دچار وضعیت هیپوگنادوتروپیک هیپوگنادال هستند.درمان خاص این گروه با تزریق ضربانی GnRH انجام می شود. این درمان شدیداً اختصاصی موجب افزایش گنادوتروپین ها ازهیپوفیز به صورت بطنی می شود ولی در عین حال موفقیت آمیزاست هرچند که مصرف ضربانی هر 90 دقیقه،نیازمند توجه خاصی است. کلومیفن سیترات نیز گاهی استفاده می شود اما درمان با گنادوتروپین نیز معمولاً به کمک گرفته می شود.
سومین گروه تشخیصی دیسفونکسیون تخمدان اختلال تخمک گذاری در دامنه ای وسیع مربوط به بیماران است که به خوبی استروژنیزه هستند.برای تشخیص این گروه از تست چالش پروژسترون در جهت ایجاد خونریزی withdrawal استفاده می شود. بطور کلی مشخصه همه این بیماران با استروژن کافی،سندرم تخمدانی پلی سیستیک است هر چند که بروز این نوع طیفی وسیع از یک اختلال خفیف فازلوتئال تا سیکل های کامل با افزایش آندروژن شدید دارد.خیلی از این بیماران بخصوص آنهایی که اختلال خفیف دارند معمولاً برای القاء تخمک گذاری به درمان با کلومیفن پاسخ می دهند.
این بیمار باردار شد و hCG برای اولین بار در سرم وی در روز بعد از نمونه گیری قابل تشخیص و ردیابی بود.
برای بیمارانی که بعد از درمان آندوکرینی یا کلومیفن باردارنشده اند،القاء با گنادوتروپین ها از جمله FSH, hMG و hCG معمولاً مناسب می باشد.تزریق hMG معمولاً بین روزهای 2 و 5 سیکل شروع می شود.درمان با پایش متناوب استرادیول و سونوگرافی تخمدان از روز ششم شروع می شود.وقتی که یک یا چند فولیکول به قطرمناسب معمولاً به اندازه 18mm رسید hCG به منظور آزاد شدن تخمک تجویز می شود.سطح استرادیول عملکرد همه فولیکول های تخمدان را نشان می دهد .بنابراین سطح استرادیول پائین با فولیکولهای بزرگ نشان دهنده این است که فرد از سطح سلامت خوبی برخوردار نمی باشد،درحالی که سطح استرادیول خیلی بالا نشان دهنده ریسک بالای تحریک بیش از اندازه بدلیل افزایش تعداد فولیکول های ریز است.
تجربه با hMG, hCG برای تخمک گذاری نشان داده است که برخی از چرخه ها بدلیل لوتئینیزاسیون زودرس (Premature luteinization) موفق نبوده اند. بعبارت دیگر LH surge یا حداقل افزایش تدریجی LH قبل از اینکه فولیکول بالغ شود اتفاق افتاده است.مهارترشح LH با آگونیست های طولانی اثر GnRH که هیپوفیز را down-regulate می کنند برای جلوگیری از پدیده لوتئینیزاسیون زودرس موثراست.امید است که این مواد ریسک تحریک بیش ازاندازه تخمدان را کاهش دهند.
درمان فرمهای خفیف و اختلال عملکرد تخمدان مثل نارسایی فازلوتئال اغلب اضافه کردن پروژسترون در فاز لوتئال است؛که این درمان می تواند با شیاف واژینال 25mg دوبار در روز انجام شود.این درمان می تواند با بیوپسی آندومترکه قبلاً با زمان چرخه تطابق نداشته ولی اکنون تطابق پیدا کرده بررسی شود.بنظر می رسد که این درمان موثر بوده و می توان آن را به تاثیرتجویز پروژسترون بر بررسی اندومترنسبت داد.مطالعات نشان داده است که در چرخه هایی که تولید پروژسترون در فازلوتئال کم است LH افزایش می یابد. گذشته از این،تجویز پروژسترون در فاز فولیکولر سبب کاهش پالس ترشح LH شده که در مرحله لوتئال طبیعی وجود دارد. این مشاهدات نشان می دهد که تجویز پروژسترون در فاز لوتئال می تواند بجای ثابت نگه داشتن شکل آندومتر درسیکل درمانی جاری یا همزمان با بکارگیری فولیکول برای سیکل بعدی،هیپوتالاموس و هیپوفیز را طبیعی سازد.
فاکتورهای دستگاه ژنیتال زنان
دستگاه ژنیتال تحتانی
اگرچه واضح است که آژنزی بطور کامل و یا قسمتی از آن مانع حاملگی است،اما این نوع مشکلات بندرت در زمان ارزیابی نازایی دیده می شوند.غالباً همه این مشکلات در حوالی بلوغ بصورت آمنوره و هماتوکولپوس آشکار می شوند.عملاً اگر توالی نزدیکی حداقل دوبار در هفته و دخول کامل صورت گیرد،فاکتور نازایی واژن وجود ندارد.
فاکتورسرویکس اغلب بصورت حرکت بد اسپرم و یا از بین رفتن اسپرم در موکوس سرویکس 1 تا 10 ساعت بعد از نزدیکی تظاهر می یابد.فاکتورسرویکس در نازایی بعنوان تنها عامل نازایی،بندرت در عمل دیده شده و براحتی می توان فهمید که موکوس سرویکس ممکن است خصوصیت بیوفیزیکی مناسب را درزنان هیپواستروژنیک نداشته باشد.شکی نیست که با موکوس سرویکس خوب در فاصله زمانی نزدیک به اوولاسیون (بعبارتی دیگر 1 تا 3 روز قبل از اوولاسیون)بیشترین علت غیر طبیعی بودن تست بعد از نزدیکی (PCT) زمان نامناسب انجام آن از چرخه است. راحت ترین روش برای تعیین زمان PCT انجام آن در روز بعد از نزدیکی (PCT) زمان نامناسب انجام آن از چرخه است. راحت ترین روش برای تعیین زمان PCT انجام آن در روز بعد از مشاهده تغییر کیت پیشگویی اوولاسیون (Ovulation Prediction Kit) است.دومین علت شایع غیر طبیعی بودن PCT فاکتور مرد است (مثل اولیگواسپرمی).به عبارت دیگراگر فاکتورمرد الیگوسپرمی نسبی داشته باشد ولی نتیجه PCT خوب باشد مشکل است که علت نازایی زوج را فقط کمبود اسپرم در دستگاه ژنیتال زن بدانیم.
علاوه برخواص بیوفیزیکی موکوس سرویکس که اجازه بقا و نفوذ به اسپرم می دهد فاکتورهایی را که ممکن است به اسپرم آسیب برسانند باید در نظر داشت.آنتی بادی ضد اسپرم در موکوس سرویکس پیدا شده است و اگر یک یا تعداد بیشتری از این آنتی بادیها برعلیه اجزاء مهم سطح اسپرم وارد عمل شوند فاکتورهای ایمونولوژیک برای نازایی بحساب می آیند.مشکل موجود وجود محدودیت های تکنیکی در افتراق آنتی بادیهای ضد اسپرم غیرموثر از آنهای است که در حرکت اسپرم یا توانایی تلقیح آن ممانعت بعمل می آورند بدون وابستگی به مکانیزمهای ایمنی،یک پروسه التهابی در سرویکس مثل سرویسیت بطورغیر اختصاصی برای اسپرم سمی است و یا از طریق تغییر خواص فیزیکی و شیمیایی موکوس سرویکس اثر می کند.چنین مکانیزم تخریبی برای نازایی را می تواند به راحتی تدبیر کرد اما داده های کمی برای تایید اینکه این امرتشخیص مهمی در نازایی است وجود دارد.
یکی از علل شایع ایاتروژنیک بر علیه موکوس سرویکس استفاده از کلومیفن برای القاء اوولاسیون است زیرا کلومیفن یک آنتاگونیست استروژن می باشد درنتیجه تحریک استروژن برای ایجاد موکوس سرویکس کم می شود بدلیل این اثر بهتر است بجای تجویز در روز 5 تا 9 سیکل در اوائل سیکل یعنی حدود روز 3تا 7 تجویز شود.
درمان مستقیم غیراختصاصی نازایی با فاکتورسرویکال،تلقیح داخل رحمی ویا تکنیکهای جدید تولید مثل به طریقه گذر مکانیکی ازسرویکس می باشد.بنابراین استراتژی درمانی برای زوج نازا با فاکتور سرویکس بررسی آینده نگر طی 6 تا 12 سیکل و انجام یک سری از روش های متعاقب آن مانند IUI شسته شده در ابتدا و بدنبال آن ترانسفرگامت به داخل لوله فالوپ GIFT و یا IVF همراه با ترانسفرجنین (IVF-ET) می باشد.بدلیل اینکه همین توالی درمان برای نازایی بدون علت نیز بکار می رود،شدیداً این تمایل بوجود آمده است که از انجام تست PCT اجتناب شود.درصورت پی بردن به یک روش درمانی اختصاصی کمتر تهاجمی در موارد نازایی ناشی از سرویکس،تمایز بین
نازایی ناشی از سرویکس و نوع ایدیوپاتیک بجای اینکه صرفاً یک تمایل آکادمیک باشد، یک اهمیت بالینی نیز می یابد.
دستگاه ژنیتال فوقانی
ارزیابی دستگاه تناسلی فوقانی زنانی شامل رحم،لوله های فالوپ و حفره شکمی می باشد که از طریق یک روش توام شامل لاپاراسکوپی، هیستروسکوپی و هیدروتوباسیون (Hydrotubation ) انجام می شود.این عمل جراحی در بیماران سرپایی نیاز به بیهوشی دارد ولی اجازه دید مستقیم حفره رحم و نیز سطح سروزی رحم و ساختمانهای اطراف آنرا می دهد؛در نتیجه باعث افزایش اطلاعات ما می شود. به نحو مشابهی،تزریق ماده رنگی در زمان لاپاراسکوپی می تواند باز بودن لوله ها و نیز مشاهده مستقیم آنها را از نظر شکل و تحرک به ما نشان دهد. تشخیص آندومتریوز و چسبندگی لگنی نیازمند دیدن حفره شکمی می باشد و تشخیص آن بدون دید مستقیم امکان پذیر نخواهد بود. هیستروسالپنگوگرافی یا سونوگرام همراه تزریق (Sonohysterogram) Saline)ارزیابی مفید را برای حفره رحم را وقتی که هیستروسکوپی در دسترس نیست،ارزیابی کند و یا بازبودن لوله ها را خصوصاً در زمانی که شک به انسداد دو طرفه در ابتدای لوله در زمان لاپاراسکوپی و هیدروتوباسیون ایجاده شده باشد،اثبات نماید.آنومالیهای داخل رحمی را می توان با هیستروسکوپی یا هیستروسالپنگوگرافی یا در زمان سونوهیستروگرام یافت .این آنومالی ها شامل باقی ماند IUD،پولیپ آندومتر،لیومیوم،چسبندگی داخل رحم و آنومالیهای اولیه دیگر می باشند.افتراق سپتوم داخل رحمی از رحم دو شاخ یا دوتایی در HSG مشکل ویا غیر ممکن است. با لاپاراسکوپی و هیستروسکوپی همزمان می توان به تشخیص سریع دست یافت و اگر دیواره ای وجود داشته باشد با هیستروسکوپی در همان زمان می تواند آنرا برداشت.
انسداد یک یا دو طرفه لوله های فالوپ بیشتر در میزان تزریق ماده رنگی خواه از طریق لاپاراسکوپی ویا HSG مشخص می شود.انسداد می تواند در ابتدا و یا انتهای لوله ویا ترکیبی از هر دو محل باشد. اگرابتدای لوله بسته باشد برداشتن آن و آناستوموزدو سر آن را می توان انجام داد. در این حالت شانس باروری مانند کسانی است که بعد از بستن لوله ها مجدداً عمل باز کردن لوله ها را انجام می دهد.در صورت نیاز به لانه گزینی مجدد (Reimplanation ) شانس حاملگی ضعیف است.بیشتراز 10% بیماران در طی 2 سال بعد از جراحی حامله نمی شوند. توبوپلاستی انتهای لوله با هیدروسالپنکس نیز بطور معمول انجام می شود و شانس حامگلی بعد از آن متغیراست. مشکل بزرگ در تخمین نتیجه بعد از عمل ،ارزیابی سالم بودن مخاط لوله است.توصیه فیمبریوپلاستی به بیماران با توجه به حدود 25% شانس حاملگی در دو سال اول، احتمالاً مناسب به نظر می رسد چرا که نتیجه از بیماری به بیمار دیگر کاملاً متفاوت است و بستگی به درجه تخریب داخل لوله دارد.تکنولوژی های جدید مثل «توبوپلاستی با بالون»ازطریق سرویکس موفقیت های متفاوتی داشته است.فن آوریهای باروری یاری شده Assisted reproductive technologies (ARTs نظیر IVF در موارد شدید نازایی ناشی از عامل لوله ای فرصت بیشتری برای کسب موفقیت نسبت به جراحی دارند هرچند لاپاراسکوپی امکان مشاهده بهتر از اختلالات نظیرتخمدانهای پلی کیستیک را می دهد،عمده ترین تشخیص مربوط به وجود وسعت چسبندگی های لگنی و آندومتریوزاست.اگرچسبندگی داخل لگن کم بوده،به نحوی که حرکت لوله را محدود کرده باشد با لاپاراسکوپی می توان چسبندگی ها را از بین برد.چسبندگی های شدید نیاز به لاپاراتومی با یا بدون توبوپلاستی دارد.لازم به یادآوری است که نتایج چنین جراحیهایی متغیراست.اگر چسبندگی ها وسیع بوده،بیمارقبلاً برای از بین بردن چسبندگی ها تحت عمل جراحی قرار گرفته است اما مجدداً از تشکیل آن رنج می برد توصیه به IVF در مدت دسترسی برای بیمار بهترین پیشنهاد است. انتخاب درمان مناسب برای بیمار بین جراحی با ART درحال تغییر است. انتخاب راه مناسب بستگی به مهارت جراح و در دسترس بودن موفقیت با تکنیکهای جدید دارد.
آندومتریوز چه بعنوان یک یافته به تنهایی و یا همراه با سایر فاکتورها بطور شایعی در لاپاراسکوپی زوجهای نازا تشخیص داده می شود. درآندومتریوز شدید که تخریب شدید لوله ها و تخمدان چسبندگی شدید لگنی وجود دارد با توانایی باروری خیلی کم در هر سیکل که فقط کمی بیشتر از صفر است همراه می باشد.بقیه فرمهای خفیف آندومتریوزازجمله خیلی خفیف،خفیف و متوسط شانس باروری در هر
سیکل را از یک دوم تا یک پنجم کاهش می دهد که این مسئله بستگی به شدت بیماری ندارد.این امردلالت بر این دارد که مکانیزم نازایی در آندومتریوز خفیف همانند آندومتریوز شدید نیست.بهترین گواه در آندومتریوز همراهی آن با التهاب داخلی شکمی است که با افزایش غلظتهای مدیاتورهای شیمیایی التهاب و افزایش تعداد سلولهای فاگوسیت فعال توام است.یکی یا هر دوی جنبه های پروسه التهابی،می تواند توجیه کننده نازایی با کاهش عمراسپرم و احتمالاً صدمه به تخمک و یا جنین شود.
درمان آندومتریوزبصورت طبی دردهای لگنی را بهبود می بخشد ولی میزان باروری در هر سیکل را بوضوح بهتر نمی کند. اغلب با رژیم های دارویی چهارتا شش سیکل را در زمان سعی در ایجاد باروری از دست می دهیم(با دانازول،پروژستین مداوم،OCP مداوم یا آنالوگهای GnRH) و این امر توام با کاهش باروری از زمان تشخیص است.حتی در صورتی که در چند ماه اول بعد از تکمیل درمان این میزان افزایش یابد.ازبین بردن نقاط آندومتریوز با استفاده از افزایش یابد.از بین بردن نقاط آندومتریوز با استفاده از لاپاراسکوپ همراه با لیزر یا کوترموفقیت حاملگی هایی که بعد از انجام این روش بوجود آمده بهبود در باروری را در بیماران بطور موقت و در آندومتریوز متوسط نشان می دهد. جراحیهای وسیع بندرت در مراحل خفیف آندومتریوز به منظور حاملگی لازم می شود اما درمان مناسبی برای آندومتریوز وسیع و چسبندگی های لگنی می باشد.قبل از آندومتریوز وسیع و چسبندگیهای لگنی می باشد.قبل از لاپاراتومی برای آندومتریوز اغلب توصیه می شود 3 تا 6 ماه درمان طبی صورت گیرد.
خیلی از نقاط کوچک آندومتریوز ناپدید می شوند.ندول های بزرگتر (برای مثال آندومتریوما در تخمدان)اندازه کوچکتری پیدا می کند و التهاب کمتر می شود.در نتیجه طرح عمل جراحی راحت تر شده و تکنیک عمل بهترخواهد بود.اگرچنین درمانهای طبی و جراحی به نظر نامناسب برسد،گام بعدی استفاده از تکنیک های جدید تولید مثل است که ممکن است شامل IUI در چرخه های سوپراوولاسیون،GIFT و IVF-ET باشد که همگی برای بیمار آندومتریوزی مقاوم به درمانهای دیگر، مناسب است.
نازایی مولتی فاکتوریال
دلیلی وجود ندارد که چند فاکتورنازایی همزمان دریک زوج وجود نداشته باشد و پزشک و بیمارباید بدانند که فاکتور شناخته شده می تواند فاکتور نباشد.ارزیابی خوب زوج نازا باید مرحله به مرحله باشد و از ابتدا از درمانهای کمترتهاجمی و مورد نیاز در اقدامات درمانی سود برده شود اختصاصاً،فاکتورگامت مرد با آنالیز منی ارزیابی می شود و فاکتور گامت زن در ابتدا با ارزیابی پروژسترون فاز لوتئال با بیوپسی آندومتر بررسی خواهد شد و بدین ترتیب کسر بزرگی از تخمین ها بعمل می آید (جدول 3).
پس منطقی به نظر می رسد که پیش از انجام ارزیابی های تهاجمی با آنالیز دقیق منی شریک جنسی مرد یا ارزیابی کامل اندوکرین شریک جنسی زن ( که با اختلال عملکرد تخمک گذاری همراه است) و درمان آزمایشی پرداخته شود.برای مثال اگراختلال تخمک گذاری وجود دارد ابتدا با کلومیفن برای 4 تا 8 سیکل اقدام می کنیم. این مدت برای ارزیابی پاسخ به درمان کافی است.سپس بقیه ارزیابی خود را با انجام لاپاراسکوپی،هیستروسکوپی وهیدروتوباسیون کامل می کنیم.اگر در تاریخچه یا معاینه بیماراحتمال تشخیص مشکلات دستگاه ژنیتال را بدهیم ارزیابی آنرا زودترانجام خواهیم داد.برای مثال اگر بیمار دیسمنوره سیکلیک پیشرونده داشته باشد بهتراست که در مرحله اول برای بهبود نازایی ودرد شکمی ارزیابی لاپاراسکوپی انجام شود.
نازایی بدون علت مشخص
نازایی بدون علت مشخص تقریباً کم است و از 5 تا 20 درصد تخیمن زده می شود،اما میزان وقوع آن با شدت کرایتریای استفاده شده اثر عکس دارد.یک زوج اگر مورد ارزیابی کامل شامل آنالیزمنی،اندازه گیری پروژسترون، لاپاراسکوپی،هیستروسکوپی و Chromoperturgation یا بدون PCT قرار گیرند،تشخیص نازایی بدون علت مشخص را می توان طرح نمود. درمان نازایی بدون علت مشخص را می تواند طرح نمود. درمان نازایی بدون علت با چند فاکتوری معمولاً امری تجربی می باشد که محافظه کارانه و یا با شدت با آن برخورد می شود. شایع ترین روش محافظه کارانه فقط تحت نظر گرفتن بیمار است. این استراتژی بدون درمان دارویی برای 6 تا 12 ماه صورت می گیرد. مرحله بعدی این درمان شامل زمان بندی دقیق برای نزدیکی با استفاده از LH surge یا مقاومت الکتریکی واژن و بزاق،تجویز کلومیفن برای 6 تا 8 سکیل یا
آنتی بیوتیک مثل تتراسیکلین برای زن یا زن و شریک جنسی او برای پاتوژنهایی که مشخص نمی باشند،خواهد بود.البته مناسب بنظر نمی رسد که حتی در بیماران جوانتر این درمان را بیشتر از 6 تا 12 ماه بعد از تشخیص نازایی ادامه داد.درمان وسیعتر و یا فرزند خواندگی را توصیه می کنیم.
جدول 3. تشخیص نازایی،تست ها و درمان ها
|
تخیص
|
انسیدانس a
(0/0)
|
تست های رایج
|
نتایج تشخیصی
|
درمان اولیه
|
درمان های پیشرفته
|
|
مولتی فاکتوریال
|
40
|
بررسی کاملB
|
تست های را جداگانه ببینید.
|
یک یا تعداد بیشتری از فاکتورهای اختصاصی را درمان نمایید.
|
،IUI ،IVF-ET GIFT
|
|
اندومتریوزیس
|
17
|
لاپاروسکوپی
|
کاشت ها و چسبندگی های اختصاصی
|
تحت نظر گرفتن ،سرکوب با دارو یا رزکسیون کنسرواتیو در لاپاراتومی
|
،IUI ،IVF-ET GIFT
|
|
فاکتور مرد
|
12
|
تجزیه منی
|
20>میلیون اسپرم متحرک طبیعی در هرانزال
|
تحت نظر گرفتن یا اهداء اسپرم
|
،IVF-ET وICSI IUI ،GIFT
|
|
دیس فونکسیون تخمک گذاری
|
11
|
پروژسترون سرم در مرحله میدلوتئال ،آخر لوتئال ،بیوپسی اندومتر
|
پروژسترون <ML/10NGغیر طبیعی است.تاخیر بیوپسی 2 روز 
|
درمان بیماریهای اندوکرین،کلومیفن
|
گنادوتروپین یائسگی یا هورمون رها کننده گنادوتروپین
|
|
فاکتور لوله ای /چسبندگی های لگنی
|
8
|
لاپاروسکوپی با هیدروتوباسیون ،HSG
|
انسداد لوله /وجود چسبندگی در لاپاراسکوپی .HSGچسبندگی ها را نشان نمی دهد.
|
لاپاراسکوپی لیزری یا لیز چسبندگی ها ET-IVFو توبوپلاستی در لاپاراتومی
|
ET-IVF
|
|
فاکتور سرویکال
|
1
|
تست پس از مقاربت
|
15>اسپرم متحرک /hpfدر فاز دیررس فولیکولی در مخاط.
|
تحت نظر گرفتن پروسپکتیو
|
GIFT ،IUI ،IVF-ET
|
|
فاکتور رحمی
|
1
|
هیستروسکوپی،HSG
|
سپتوم ،پولیپ،فیبروئید دیده می شود،hsg منفی کاذب بالایی دارد.
|
رزکسیون هیستروسکوپیک
|
متروپلاستی در لاپاراتومی
|
|
ایدیوپاتیک
|
10
|
بررسی کامل
|
تست ها را جداگانه بررسی نمایید.
|
بررسی پروسپکتیو،درمان تجربی ،کلومیفن یا آنتی بیوتیک های تجربی
|
IUI ،IVF-ET GIFT
|
وقتی که لوله فالوپ بسته و یا وجود نداشته باشد و علاوه برآن در تشخیص های مختلف دیگری نیز با درجات موفقیت متفاوت بکار می رود.وقتی لوله فالوپ وجود داشته باشد و طبیعی به نظر برسد از GIFT یا تحریک تخمک گذاری با IUI می توان استفاده نمود.استفاده از اینها درمان موثری برای بسیاری از زوجها با تشخیص های مختلف است. برای استفاده از تمام این تکنیک ها نیازبه القا تخمک گذاری و استفاده از داروهای مربوط به آن جهت افزایش تعداد اووسیت ها است. اینکه این تکنیکها واقعاً چقدر باعث افزایش میزان حاملگی در سیکلهای متعدد می شوند و جزئیات بیشتر آنها را در بقیه این فصل ملاحظه خواهیم نمود.
فن آوری باروری یاری شده (ART)
stillman و همکارانش اصطلاح جمع آوری گامتها با یکدیگر (getting gametes together) را هدف اصلی ARTs در درمان نازایی می دانند.درمورد انسان ARTs در اواسط دهه 1970 شروع شد. با تجربه در گرفتن اووسیت،IVF و استفاده از محیط کشتهای مناسب و انتقال جنین به رحم خیلی از سیکلها بدون استفاده از دارو انجام می شود.سپس تکنولوژی مانیتورینگ در فاز قبل از تخمک گذاری مثل اندازه گیری استرادیول،LH و سونوگرافی بوجود آمد.این پروسه ها به تولد Louise Brown در 1978 با روش Steptoe & Edwards منجرشد.بعد از تولید این بچه، ARTs در صدها مرکز در سراسر دنیا انجام شد.هزاران بچه ازاین طریق متولد شدند که درسالهای قبل هرگز نمی توانستند پا به عرصه گیتی نهند.متاسفانه سردرگمی در میزان موفقیت در تکنیکها و گروههای مختلف تصمیم گیری بیماران را مشکل کرده است.سرانجام بدلیل عدم قبول بیمه برای این درمانها خیلی از بیماران از انجام این تکنیکهای پرهزینه صرف نظر می کنند. بدلیل اصرار بعضی بیماران راههای کم هزینه ترازجمله سعی برای جراحیهای لوله حتی وقتی اندیکاسیون کمی برای آن وجود دارد انتخاب می شود امید است که اختلاف بین علوم،تکنولوژی و شرکتهای بیمه بطریقی حل شود که همگی دست به دست هم داده تا درمان نازایی به بهترین و موفقیترین راه انجام شود.
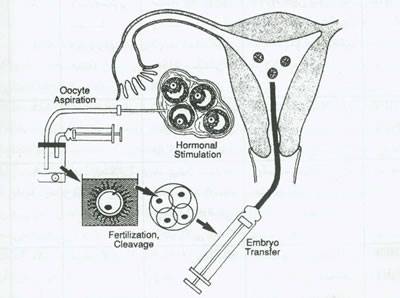
ART شامل پروسه های متعدد و مملو از لغات متعددی است که انواع واریاسیون های IVF را شرح می دهند.شکل 7 مراحل IVF را نشان می دهد.سپس cryo[erervation تخمک و رویان در مراحل بعد قرار دارند.
شکل 7. مراحل باروری آزمایشگاهی (IVF) و جایگزینی جنین شامل تحریک تخمدان،پایش،اولتراسوند یا لاپاروسکپی، نگه داری اووسیت، IVF و جایگزینی پیش رویان در رحم است.
علاوه بر IVF،سایرتکنولوژیها شامل GIFT, (ZIFT Transfer Intratallopian zygote , TET transfer embryo tubal TUTT insemination tubal transuterine manipulations gamete و Intracytoplasmic injection ICSI می باشد.
هریک ازاین روشها به نوبه خود سبب ارتقاء کاربردهای کلینیکی در روشهای جدید ART گردیده است.
اطلاعات بدست آمده ازART سبب ارتقاء تجربه و درک مفاهیم فیزیولوژیک، پاتوفیزیولوژیک،عملکرد تخمدان،ذخیره تخمدان،عملکرد اسپرم،لقاح،کشت و سیستمهای مربوط به آن،به وجود آمدن جنین،لانه گزینی و Cryotherapeutic شده است.
این حوزه پیشرفت در درمان نازایی همچنین باعث ارتقاء تشخیص و درمان سایر رشته ها گردیده است.برای مثال تحقیقات کاربردی ARTs سبب پیشرفت در زمینه های جلوگیری از لقاح،پیشرفت در تشخیص ها و درمانهای ژنتیک در جنین قبل از لانه گزینی و پیشرفت در مامایی برای جلوگیری از ریسک جنینی درمادری که قبلاً نسبت به Rh حساس شده است، گردیده است.دو مورد آخرنمونه هایی از درمان برای زوج هایی است که نازایی ندارند.برنامه ART ادامه می یابد و تازه های آن شامل افزایش پیچیدگی هایی است که سعی در تسهیل آن است.
پزشکان سعی می کنند تکنولوژی هایی را بکار بگیرند که زوجهای خیلی بیشتری را که در جستجوی آن هستند درمان نمایند و همچنان ریسک کمتر و هزینه کمتری را تحمیل نمایند.درادامه این بخش ما ابتدا اجزاء یک ART نمادین را بررسی می کنیم وسپس روند افزاینده تکامل و پیچیدگی این فن آوریها و همچنان آسان سازی آن را پی می گیریم.
سپس وسیله هایی که موجب به حداکثر رسیدن کارایی ART در باروری می گردند را مرورخواهیم نمود.این روشها شامل ارزیابی کیفیت اووسیت،کیفیت اسپرم و جنین و ظرفیت لانه گزینی است.
پارامترهای سیکل ARTs
انتخاب بیمار
این روش زمانی برای بیماران مبتلا به فاکتور لوله ای که پس از جراحی لوله باردار نمی شوند انجام می شد.امروزه اندیکاسیونهای ARTs گسترش یافته و شامل تمام گروههای نازایی می باشد. ARTs که زمانی فقط برای درمان اشکالات غیر قابل درمان لوله بکار می رفت امروزه گامتهای متعددی را برای بهبود باروری درمشکلات گوناگون بدست می آورد.برخی محققین تاکید برخلاصه کردن بررسی استاندارد ناباروری دارند و پیشنهاد می شود درآینده نزدیک پس از یک بررسی مختصر رحمی،اندازه گیری FSH روز سوم و پارامترهای منی بعضی انواع ARTs شروع شود.گرچه این دیدگاه درنازایی احتمالاً نیاز به افزایش درجه موفقیت
ARTs در هرسیکل دارد ولی اندیکاسیونهای ARTs دیگر فراتر از درمان مخص به یک لوله تخریب شده است.
IVF موفق در حضور پارامترهای مختل منی باعث استفاده مکرر از IVF برای اینگونه بیماران شده است. بهر حال وقتی Male Factor و Tubal Factor طبیعی باشند، ممکنست ARTs با انتقال گامت به لوله فالوپ یا نزدیکی آن موفقیت آمیزباشد. این گروه ممکن است بیماران مراحل اولیه اندومتریوز و نازائی ناشناخته را در بر گیرد ولی برخی از پزشکان هنوز تشخیص قدرت باروری تخمک و اسپرم را بوسیله IVF بیش از انتقال گامت حتی برای این اختلالات موجه می دانند. نسبت خطربه فایده و هزینه به سود هر نوع ARTs باید در هر مرکز محاسبه گردد و البته با استفاده از آمار خود مرکز برای مقایسه درمانهای گوناگون این کار انجام شود.
اندیکاسیونهای ARTs امروزه برای نازایی در وراء تعاریف معمول ناباروری گسترش یافته و شامل زنان پره منوپوز و یائسگی زودرس با اهداء تخمک،مادران اجاره ای برای زنان فاقد رحم فونکسیونل، ژنیتک لانه گزینی و عدم هماهنگی های مادر و جنین مثل حساسیت شدید Rh یا شیمی درمانی مادر می باشد.گستردگی طبقه بندیهای بیماران،با یا بدون رحم، و با یا بدون نازایی تبدیل کرده است. در عوض،با ایجاد روشهای متعدد برای اداره این گروهها مانند سیکل های همزمان برای رحم اجاره ای و بیوپسی رویان برای ژنتیک قبل از لانه گزینی این میدان را بسیار پیچیده تر ساخته است.
تحریک تخمدان
ART با استفاده از چرخه طبیعی و بازیابی یک فولکیول غالب که در سکیل قاعدگی رشد می کرد،شروع شد.وقتی این روش بعلت تفاوت در توانایی بازیابی لقاح و کشت یک اووسیت رسیده اما لوتئینیزه نشده موفقیت بسیار کمی نشان داد،تحریک تخمدان با کلومیفن و مواد مرکب شامل hMG مد نظر قرار گرفت.شایعترین روشهای مورد استفاده آنالوگ GnRH برای از کار انداختن موقت هیپوفیز و سپس تحریک با گونادوتروپین ها با دوز بالاست.براین اساس انواع بی شماری از تحریک تخمک گذاری وجود دارد.
از جمله افزودن FSH خالص و نوترکیب،هورمون رشد و تشدید نمودن با آنالوگ GnRH (بعبارت دیگر تحریک یا آنالوگ GnRH به همراه تحریک با گونادوتروپین دوز بالا)، با هدف گول زدن طبیعت برای ایجاد اووسیت هایی متعدد جهت IVF و انتقال برای IVF پس از GIFT بوده است.پس از تحریک مناسب تخمدان،آنالوگ GnRH وتحریک گوناد قطع می شود و hCG بعنوان جایگزین LH جهت تحریک تخمک گذاری حدود 36-35 ساعت پیش از برداشت برنامه ریزی شده اووسیت تجویز می شود تا باعث تعامل نهایی اووسیت در بدن شود.
حفاظت دوره لوتئال پس ازاسپیراسیون اووسیت ها، مایع فولیکولی،سلولهای گرانولوزا توسط پروژسترون،دوزهای منقسم hCG و بدون اقدام اضافه انجام می شود.علیرغم تحقیقاتی که از لحاظ آماری اختلاف مهمی در موفقیت حاملگی بین رژیمهای مختلف حفاظت لوتئال را نشان نداده اند،بیشتر گروها یک راه درمانی را بر می گزینند که احتمالاًموثرترین آنها تجویز hCG است.
برای صرفه جویی،ایمنی و کاهش ریسک چند قلویی یک پروسه تحریکی تسهیل شده با تکیه براصول حداقل تحریک با کلومیفن در طی سیکل طبیعی با گرفتن اووسیت و سپس کشت اووست های نابالغ همگانی شده است. موفقیت ART در هر سیکل معمولاً مستقیماً با تعداد رویانهای تکامل یافته برای استفاده در چرخه بستگی دارد.چون در این شکل سیکل انتظار انتقال جنین های کمتری از چرخه های تحریک شده با گوناوتروپین را داریم، تصمیم برای بیمار بر پایه آسانی،ارزانی یا ریسک روش و احتمال بارداری در یک چرخه تنهاست.بهبود روشهای کشت، از جمله استفاده از سیستمهای Coculture (کمک کشت) و انتقال رویان ها در هرمنطقه بلاستوسیست ممکن است با تعداد کمتر رویان ها،درصد لانه گزینی را افزایش دهد.
پایش (Monitoring)
پایش تکامل اووسیت بر اساس آزمایش LH ادراری به استرادیول سرم و سونوگرافی واژینال روزانه فولیکول تکامل یافته است.بررسی سونوگرافیک جهت بررسی ضخامت و الگوی اندومتر نیز به این بخش افزوده شده است.قبل از استفاده از آنالوگهای LH, GnRH سرم یا ادرار و پروژسترون سرم نیز به تشخیص دوره تکامل اووسیت و کاهش
لوتئینیزاسیون زود رس در انتهای مرحله فولیکولی کمک می کردند.با استفاده از آنالوگهای GnRH خطر افزایش های ناشناخته و ناخواسته LH و لوتئینیزاسیون زودرس قبل از گرفتن اووسیت اهمیت کمتری دارد.
امروزه آنالوگهای GnRH فقط بصورت آگونیست در دسترسند.پس از تحریک اولیه،آگونیست GnRH کار هیپوفیز و تخمدان را مهار می کند.بنظر می رسد اینکار اجازه همزمانی تکامل اووسیت ها را در پاسخ به تحریک بعدی با گونادوتروپین،حذف افزایش LH جهت پیشگیری از تخمک گذاری خودبخود پیش از بازیابی اووسیت و محدود ساختن لوتئینیزاسیون زودرس فولیکول بعلت افزایش پروژسترون مهیا می سازد.نتیجه کاهش شدید در از بین رفتن چرخه ها و افزایش در تعداد اووسیت های گرفته شده در هر چرخه است. میزان باروری،نشانگر تعداد رویانهای منتقل شده و میزان بارداری در سیکل است.بسیاری از پزشکان از آنالوگ GnRH برای کنترل سیکل سود برده اند (بعبارت دیگر،روزهای شروع برای گونادوتروپین،زمانبندی تحریک تخمک گذاری با hCG) تا خونریزی بیمار در طی یک دوره ART منظم شود.
نیاز به افزودن GnRH که از راه زیر جلد یا اسپری بینی تجویز می شود و مقادیر افزایش یافته گونادوتروپین معمولاً در مقابل فایده آنها بی ارزش می گردد. این نسبت هزینه به منفعت باید با تولید آنتاگونیستهای خالص GnRH افزایش یابد. پایش سیکل در جهت کاهش قیمت و آسانتر شدن،پیشرفت کرده است.دربرخی برنامه های استاندارد شده به بیماران یک رژیم داروئی تغییر نیافته با مانیتورینگ ضعیف یا بدون آن داده می شود.گرفتن تخمک برای روز خاصی برنامه ریزی می شود.برخی از این پروتکل ها به همان اندازه روش های مداخله ای موفقیت باروری داشته اند.
پروتکل های بسیار مداخله گرانه تر مانیتورینگ اقماری نیز به ویژه در برخی مناطق حاشیه نشین موفق بوده است. بیماران ART در یک مرکز محلی پایش شده و سپس بر اساس معیارهای استاندارد برای گرفتن اووسیت و مراحل آزمایشگاهی گامتها و رویانها به تسهیلات مرکزی فرستاده می شوند.این کار فوائد بسیاری برای بیمار داشته و نیاز به ایجاد مراکز و افراد تخصصی را کم می کند.
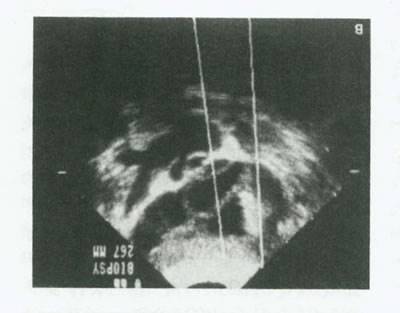
گرفتن اووسیت
درمراحل اولیه تکامل ART، لاپاراسکوپی روش استاندارد گرفتن اووسیت بود.براساس پیشرفتهای فناوری در اواسط دهه 80 مشخص شد که فولیکولهای رسیده 18 میلیمتریا بیشتر را می توان تحت راهنمائی سونوگرافی خارج کرد.چنین کوششهائی در ابتدا با استفاده از سونوگرافی ابدومینال با یا بدون راهنمائی فورسپسهای شکیمی بیوپسی انجام می شد. سپس روش ابدومینال با یک سوزن آزاد اسپیراسیون واژینال انجام گرفت.امروزه روش استاندارد اسپیراسیون واژینال با راهنمای سوزن فیکس روی پروب واژینال است(شکل 8). ندرتاً راههای پری یورترال، ترانس وزیکال و رحمی در شرایط ویژه به علت محلی غیر طبیعی تخمدانها بکار می روند. به تازگی گرفتن اووسیت از راه لاپاراسکوپی همزمان با لاپاراسکوپی تشخیصی برای علت ناباروری انجام می گیرد. این برخورد همراه لاپاراسکوپی تشخیصی و درمانی در ناباروری با IVF و GIFT زود هنگام بکار می رود. در بیمارانی که به منظور بررسی، لاپاراسکوپی می شوند تحریک تخمدان پیش از لاپاراسکوپی و مانیتورینگ انجام می شود. زمانبندی لاپاراسکوپی توسط زمان لازم برای گرفتن اووسیت مشخص می شود.اگر مایع منی و پارامترهای لوله ای طبیعی باشند. می توان GIFT انجام داد. اگر هر یک ایده آل نباشند یا اطلاعات تشخیصی درباره IVF لازم باشد، IVF و جایگزینی رویان را در رحم انجام می دهیم. بیمارانی که شانس بارداری از راه ART با لاپاراسکوپی را دارند، در صورت عدم موفقیت،لاپاراسکوپی می تواند علت ناباروری را روشن و آن را درمان کند.
شرایط کشت آزمایشگاهی
روشهای آزمایشگاهی بسیار پیچیده و گمراه کننده اند،حتی با وجود تلاشهایی که برای سادگی و استاندارد کردن این روشها پایه ریزی گردیده است.این گمراه کنندگی با روشهای سختگیرانه کنترل کیفیت ،استفاده از محیط کشت جدید فن آوریهای کمک کشت افزایش یافته است. برخی تلاشها برای آسان سازی،مانند سیستم های کشت داخل واژن موفق عمل کرده اند.انتقال گامتها به تسهیلات متمرکز برای کشت و انتقال پیش رویانی پس از گرفتن محلی اووسیت تا حدودی موفق بوده است.
شکل 8: آسپیراسیون اووسیت تحت سونوگرافی ترانس واژینال پس از تحریک تخمدان.B:تصویر اولتراسوند ترانس واژینال یک تخمدان هیپراستیموله در طی بازیابی اووسیت.معیارهای راهنمای بیوپسی نرم افزاری و سوزن اکوزنیک درخشان با یک فولیکول قابل مشاهده اند.
جایگزینی گامت و رویان
انواع متعددی از روشهای جایگزینی گامت و رویان بکار رفته اند.رویکرد استاندارد جایگزینی پیش رویانی در مرحله 8-4 سلولی، معمولاً 72-48 ساعت پس از کشت در رحم است. دراین روش تلاش می شود پیش رویان در طی دوره پنجره لانه گزینی (Implantation Window) اندومتر جایگزین شده و زمان کشت را کوتاه می کند.جایگزینی پیش رویان در رحم از راه سرویکس زودتر از زمانی که رویان بطور طبیعی از لوله به رحم می رسد صورت می گیرد.هر چه پیش رویان زمان طولانی تری در کشت بماند،درجه همزمانی اندومتر و پیش رویان کاهش می یابد زیرا اندومتر به صورت Invivo سریعتر از پیش رویان کشت شده (invitro) رشد می کند.اگرجایگزینی زود هنگام کاهش زمان کشت پیش رویان در میحط مصنوعی
آزمایشگاه مهم است،درعوض در پنجره جایگزینی اندومتریال خیلی زودتر در محل مناسب خود قرار می گیرد. پس تکنولوژی های بهترکشت یا متدهای جایگزینی دیگر لازمست. ZIFT یا GIFT به نظر می رسد به هر دوهدف می رسند. GIFT و ZIFT برای تسهیل این روش،بدون استفاده از کشت آزمایشگاهی به وجود آمدند.
همانگونه که ذکر آن رفت، IVF ابتدا در درمان نازائی با فاکتور شدید لوله ای استفاده شد.سپس موفقیت آن منجر به گستردگی اندیکاسیونهای آن در بیماران بدون فاکتور لوله ای شد و پرسشهائی در مورد شرایط بالینی که باید از IVF، کشت و جایگزینی پیش رویان دررحم اجتناب شود بویژه در حضور لوله های طبیعی مانند نازائی ناشناخته یا اندومتریوز خفیف بوجود آمد. GIFT کوششی بود که به این نیازها پاسخ می داد.این متد در حقیقت آسان سازی روشهای کشت IVF بوده بطوری که از شرایط سخت آزمایشگاهی با استفاده از لوله های بیمار بعنوان انکوباتور به جای لوله و انکوباتورهای آزمایشگاهی پرهیز می شود.
TET و ZIFT مشتقات تکنولوژیک GIFT بودند.این روشها بر شکست GIFT از قبیل فاکتور مردانه،فائق آمدند.همچنین این روشها زمان مورد نیاز خارج از بدن را کاهش دادند و بطور فیزیولوژیک فرصت تکامل پیش رویانی داخل لوله ای و زمانبندی انتقال به رحم را بوسیله جایگزینی در لوله فالوپ فراهم آوردند.درابتدا آنها نیاز به گرفتن اووسیت،بعضی کشتهای آزمایشگاهی و انتقال لاپاراسکوپیک رویان دارند. موفقیت با ZIFT ترانس توبال یا TET پس از گرفتن اووسیت از راه واژینال و کشت خارج بدن ناامید کننده بوده اند.
تحقیقات تصادفی،علیرغم روشهای قبلی جایگزینی پیش رویان در لوله حتی با IVF پاراسکوپیک در مقایسه با TFT و انتقال پیش رویانی،هیچ افزایشی در موفقیت بارداری نشان ندادند. بهر حال کار بیشتر و تغییرات دراین روشها شاید با کانول زدن لوله از راه سرویکس با استفاده از Linear Everting Catheters لازمست.
کماکان ساده سازی بیشتر ART در بیمارن با لوله های طبیعی متوقف نشده است.بلکه تلاش های متعددی صورت گرفته که از این جمله انتقال اووسیت و اسپرم به طریقه پریتونئال است (POST)،که نیاز به گرفتن اووسیت با اولتراسوند بدون انتقال گامت با لاپاراسکوپی دارد.اووسیت و اسپرم برای گرفته شدن بوسیله لوله در داخل بن بست دو گلاس گذاشته می شوند. کوششهای بعدی برای ساده سازی این فرایند شامل هیپراستیمولاسیون کنترل شده تخمدان بدون گرفتن اووسیت است.این شامل تلقیح مستقیم اسپرم بداخل پریتوان DIPI=Direct Intraperitioneal Insemination و TUTI بود.با تلاشهای گام به گام در ساده سازی نوع پیچیده ابتدایی IVF با استفاده از تحریک بیش از حد تخمدان و رشد اووسیت های متعدد در هرماه این روش از IVF به GIFT تا ZIFT یا TET تا POST و بازگشت به IVF تغییر یافت.
قابلیت باروری
ART یعنی افزایش قابلیت باروری از جمله در کیفیت اووسیت،اسپرم،رویان و ظرفیت لانه گزینی،که در قسمتهای بعدی توضیح داده خواهد شد.
کیفیت اووسیت
سن باروری نسبت عکس با قدرت باروری دارد. مقدار hMG مورد نیاز برای تحریک تخمک گذاری با سن بالا می رود، درحالی که تعداد اووسیت های قابل دریافت،تعداد پیش رویانهای انتقال یافته و درصد بارداری در هر چرخه همگی در زنان مسن تر بخصوص در سنین بیش از 60 سال کاهش می یابند.تلاشهای شکست خورده ART که بعنوان درصد منفی شدن سیکل ها و سقط خوانده می شود،نیز بالاترند.این اختلال پایه وابسته به سن مادر در افزایش میزان موفقیت با انتخاب اهدا کننده اووسیت بسیار روشنتر
می شود.اووسیت های دهنده امروزه به فراوانی در زنان مبتلا به ذخیره کم تخمدان (که با FSH بیش از 12mIu/ml یا استرادیول مساوی یا بیش ازروز 3 سیکل یا روز دهم، 5 روز پس از درمان با کلومیفن مشخص می شود)،سایر گروههایی که از تخمک دهنده استفاده می کنند شامل اختلال آناتومیک که از تخمک دهنده استفاده می کنند شامل اختلال آناتومیک و عدم دسترسی به تخمدان برای گرفتن اووسیت،شکست های مکرر IVF بعلت فقدان لقاح بدون فاکتور مردانه،اختلالات مشخص ژنتیک،نازایی ثانویه تخمدان در نتیجه دیس ژنری گونادال، جراحی،شیمی درمانی یا اشعه است.احتمال دارد که بعضی گروههای اووسیت گرفته شده از سیکلهای طبیعی یا تحریک شده قادر به لقاح نباشند.بعضی ممکن است نارس باشند، بعضی بیش رس و برخی ناهنجاری هایی در Zone pellucida یا چسبیدن به اسپرم داشته باشند.
سن بلوغ مناسب برای قابلیت لقاح مهم است.فن آوری جدیدتر اجازه رشد اووسیت های نارس را با استفاده از تکنیکهای مخصوص کمک کشت مهیا ساخته است.
نهایتاً کیفیت اووسیت با احتمال تکامل پیش رویانهای بهتر و احتمال بالاتر لانه گزینی و بارداری نسبت دارد.کیفیت اووسیت می تواند با پارامترهای مختلف از محیط کشت (مانند نسبتهای اندروژن به استروژن) بررسی شود.جذب کموتاکتیک اسپرم با اووسیت همینطور سایر بررسی های بیوشیمیایی سلامت و بلوغ اووسیت و قدرت ما در تأثیر بر کیفیت اووسیت میادین پژوهشی دیگر هستند.
کیفیت اسپرم
یکی از بزرگترین پیشرفتهای ARTs در درمان فاکتور مردانه نازائی بوده است.حتی تعاریف نازائی متوسط وشدید مردان تغییرزیادی نموده است.بررسی های مختلف بیوشیمیایی سابقاً در بررسی عمل اسپرم استفاده می شدند،اما معمولاً نا امید کننده بودند.گرچه IVF-ET بعنوان درمان نازائی لوله ای آغاز شد بسرعت مشخص شد که غلظت اسپرماتوزوآ که برای لقاح لازم است می تواند در مردانی که مشکل شدید پارامترهای اسپرم دارند نیز بکار رود.امروزه تعداد کمی اسپرم حتی با حرکات کم یا ثابت می توانند با فناوریها Micromaniputation مانند ICSI به باروری برسند. بیوپسی بیضه،آسپیراسیون با سوزن ظریف، یا آسپیراسیون اسپرم از راه اپیدیدیم ICSI را حتی در مردانی که آزوسپرمی دارند،قابل دسترس و موفق ساخته است.اسپرم اهدائی ممکن است بعنوان کمک در تمام این روشها بکار رود.بخصوص برای کسانی که حتی با این روشهای فوق العاده،احتمال موفقیت شان کم است.
کیفیت پیش رویان
در یک کوشش برای افزایش قابلیت باروری در ARTs می توان کیفیت پیش رویان را بطور مورفولوژیک،بیوشیمیایی و کروموزومی بررسی کرد.نمونه هایی از این روشها اندازه گیری سلامت و کیفیت پیش رویان و چگونگی افزایش این کیفیت در قسمتهای بعدی شرح داده شده است.بهرحال با پیشرفتهای وسیع و سریع در این مورد،این مثالها فقط یک دیدگاه سطحی از آنچه این روشها در آینده به ارمغان خواهند آورد ارائه می کند.
بررسی مورفورلوژیک
بررسی مورفورلوژیک پیش رویانها در آزمایشگاههای ART برای تصمیم گیری اینکه کدام رویان از گروه تولید شده اووسیت های متعدد منتقل شود انجام می گیرد.پیش رویانها برای بیشترین احتمال لانه گزینی انتخاب می شوند. کریتاریای مورد استفاده برای این بررسیها کیفی و تا حدودی حدسی هستند.تعداد سلولها یک کریتاریای کلاسیک است.تکامل سریعتر با میزان بیشتر لانه گزینی همراه است.مرحله 8-4 سلولی در 48 ساعت بعنوان یک هدف استفاده می شود.تقارن و گردی بلاستومرها و فقدان فراگمانتاسیون (تکه ای بودن) واکوئولها کریتاریای استفاده شده توسط امبریولوژیست است. پیشرفتهای بررسی کیفی و نیمه کیفی وراء این بررسی مورفولوژیک نیز مورد تأیید است.
بهبود در کیفیت پیش رویان آنچنانکه با این کریتاریای مورفولوژیک بررسی شده می تواند بوسیله تست دقیق کنترل کیفیت و آماده سازی دقیقترمحیط کشت انجام شود. پیشرفتهای سیستم های کمک کشت ممکن است باعث
بهبود میزان بلاستومرها،کاهش میزان فراگمانتاسیون و افزایش در چسبندگی بلاستومرو تغییرات و ضخامت Zons prllucide شود.
این سیستم کشت اجازه رشد رویان تا مرحله بلاستوسیست را می دهد که در آن درصد بلاستوسیست های قابل لانه گزینی افزایش می یابد.
تحرک و خروج رویان از زوناپلوسید از اعمال حیاتی یک رویان پیش از مرحله لانه گزینی بشمار می روند.پیشنهاد شده است که خروج و لانه گزینی زمانی بیشترین احتمال را دارد که پیش رویان ها از نظر ضخامت زوناپلوسیدا با هم تفاوت زیادی داشته باشند.بنظر نمی رسد یک زوناپلوسیدا ضخیم یا بدون اختلاف ضخامت بتواند به همان اندازه لانه گزینی را به انجام برساند.این مسئله باعث برقراری خروج پیش جنین به کمک تکنیکهای جدید شده است.
ارزیابی بیوشیمیایی
پره آمبریو قادراست در بدن از نظر بیوشیمیایی فعال باشد.اگربعضی از آنها در خارج از بدن قابل ارزیابی باشد،اندازه گیری میزان سلامت پره آمبریوامکان پذیر است.
همانطورکه قبلاً در ارزیابی سلامت اووسیت اشاره شد برای ارزیابی بیوشیمیایی پره آمبریو نیز از Spent Culture Media استفاده می شود. ارتباط محیط کشت و محصولات جنین می تواند ازانتخاب پره امبریو سالم قبل از implantation و مشخص نمودن آنهایی که امکان کمتری برای زنده بودن دارند، تعیین شود.ارزیابی مواد سنتزشده بوسیله پره آمبریو در کشت به خصوصیت و سنتز دیرتر این مواد شیمیایی،ازجمله فیبرونکتین (Oncofetal fibronectin)،پروتئین A پلاسما درحاملگی و مولکولهای انتگرین (integrin) منتهی می شود که همگی موادی هستند که در تشخیص،درمان و ارزیابی پره آمبراستفاده می شوند.
ارزیابی کروموزومی
دستکاری میکروسکوپیک در لقاح میکروسرژیکال و خروج کمکی برای لانه گزینی استفاده می شود.ارزیابی کروموزومی کیفیت پره آمبریو همچنین دستکاری های میکروسرژیکال مانند بیوپسی از بلاستومر را به منظور تشخیص تحت تأثیر قرار داده است.پیشرفت دراین زمینه برای درمان پره آمبریو بوجود آمده، پیشرفت در زمینه ژنتیک قبل از لانه گزینی جداری از درمان نازایی و استفاده از جدیدترین ابزارهای بیولوژی مولکولی مثل (Polymeras chain reaction) PCR) و fluorescent in situ hybridization یک از مثالهای عالی اهداف طبی در استفاده از ARTs می باشد.
توانایی درمانهای ژنی بوسیله gene insertion در حیوانات انجام شده است. ولی در انسان هنوز باید بررسی شود. استفاده از این ارزیابی ژنی حتی در بیمارانی که نازا نیستند استفاده می شود. در بیماران با مشکلات وابسته به X-linkde که زایایی طبیعی دارند می تواند از این تکنولوژی برای به حداقل رساندن مشکل ژنتیک استفاده کرد.
استفاده از ART همراه با بیوپسی بلاستومر در پره آمبریو امکان انتخاب جنسیت و سایر اندیکاسیون های غیرطبی را دراختیار می گذارند.
ظرفیت لانه گزینی
قابلیت قبول رحم مادر و آندومتر رل مهمی در لانه گزینی خودبخود و یا استفاده از روشهای کمکی دارد.بیشتر تحقیقات کلینیکی در مورد لانه گزینی در ART می باشد چون ظرفیت لانه گزینی از فاکتورهای محدود کننده حاملگی است.
محیط هورمونی
سطوح بالای استرادیول،گاهی در ترکیب با پیامدهای ناخواسته ضد استروژنی کلومیفن ممکن است ظرفیت کاشت اندومتررا پس از هیپراستیمولاسیون کنترل شده تخمدان تحت تأثیر منفی قرار دهد.
زمان مصنوعی انتقال پیش رویان (Pre-embryo) به رحم نیز ممکن است در این زمنیه نقش داشته باشد.مکانیسمی که از طریق آن می توان بر اینگونه محدودیت های کاشت جنین فائق آمد انتقال چند پیش رویان (Multiple Pre-embryos) است.این مسئله بحث اخلاقی ایجاد چند جنین و عدم انتقال تمامی آنها و نیز
حاملگی چند قلویی را به دنبال دارد.میزان کاشت (Implantation rate) در موفق ترین برنامه های 10,IVF تا 15% به ازاء هر پیش رویان است.مقادیربالاترنیز امکانپذیربوده و گاهی قابل دستیابی است. این میزان هنگامی که چرخه های مصنوعی با بکارگیری متوالی رژیم استروژن و پروژسترون ایجاد شده و امکان انتقال پیش رویان در طی Implantation window فراهم می آید،افزایش خواهد یافت.میزان کاشت در برنامه های اهداء اووسیت،با استفاده از اووسیت خود فرد بهبود یافته و این بهبودی در صورت استفاده از اووسیت خود فرد بهبود یافته و این بهبودی در صورت استفاده از چرخه های مصنوعی اندومتریال با استفاده از تنظیم کاهشی GnRH در صورت نیاز و درمان متوالی با استروژن و پروژسترون متوالی بیشتر می شود.ارزیابی اندومتر در طی چرخه های مصنوعیی بدون انتقال همراه با بیوپسی اندومتر یا سونوگرافی از اندومتربه منظور ارزیابی ضخامت و الگوی اندومتر امکان ارزیابی ظرفیت کاشت اندومتریال را فراهم می آورد.
جهت گیری بالینی دیگری که برای بهبود پذیرش اندومتر طراحی شده است استفاده از چرخه های طبیعی IVF می باشد. اصطلاح طبیعی (Natural) که همراه با IVF بکار می رود،نام Steptoe و Edwards را به ذهن متبادر می سازد، زیرا آنها نخسیتن کسانی بودند که یک اووسیت مجزای غالب را از یک چرخه تحریک نشده در حال پایش جدا نمودند. چرخه طبیعی ازنظرتئوری محیطی طبیعی و تحریک نشده را برای کاشت در اندومتر فراهم می آورد.
حفظ هزینه،سادگی برای بیماران و به حداقل رسانیدن خطر حاملگی چند قلویی و سایر مسائل اخلاقی مربوط به ایجاد جنین های اضافی نیز از این طریق تأمین می شود.میزان کاشت تقریباً 10% که برای این چرخه ها گزارش شده به نظر نمی رسد که بهبود چشمگیری نسبت به میزان کاشت چرخه های تحریک شده (Stimulated cycles) داشته باشد.
کارآزمایی های تصادفی نتایج مثبت مربوط به اندومتررا نشان داده اند.درصورت بهبود کافی فن آوری های Cryopreservation ،باید Cryopreservation تمامی پیش رویان ها از یک چرخه تحریک شده و تأخیرانتقال آنها به چرخه های آندومتریال مصنوعی یا طبیعی دیررس (یعنی جدا از اندومتر تحریک شده و چرخه مورد نظر) در نظر گرفته شود.بلوغ imvitro اووسیت های نابالغ حفظ شده بدون تحریک،امکان موفقیت بیشتر در چرخه های تحریک نشده را نسبت به چرخه های با یک اووسیت مجزا متوقف ساخته است.
یکی ازروش های اصلاح کاشت در ARTs قرار دادن گامت ها یا پیش رویان ها در یک محیط فیزیولوژیک از جهت باروری و تقسیم د زودرس سلولی (لوله فالوپ) است. این جایگزینی ما را از اینکه پیش رویان ها از لوله فالوپ به درون رحم در طی Implantation فیزیولوژیک رها می شوند،مطمئن ساخته،مشکلات ناشی از سیستم کشت رویان در invitro و عدم هماهنگی رشد اند و متریال را مرتفع می سازد.GIFT امکان باروری در لوله فالوپ، تکامل طبیعی پیش رویان و انتقال طبیعی آن به درون رحم را فراهم می آورد.گرچه میزان کاشت به ازای هر رویان بالاتر است،کاهش باروری را خصوصاً در مقایسه با IVF در برنامه های ART که در آن میزان موفقیت حاملگی IVF بالاست در پی دارد.
پذیرش رحم (Uterine Receptivity)
محیط اندومتر و ظرفیت کاشت نیز ممکن است تحت تأثیرخود رحم قرار گیرد. چسبندگی (Synechiae) قابل توجه، مالفورماسیون های رحمی،قرارگیری در معرض دی اتیل استیل بسترول در رحم و لیومیوماتای رحمی پایدار ممکن است ظرفیت کاشت و به تبع آن موفقیت تولید مثل در اثر ART را کاهش دهند.این ناهنجارها را در صورتی که قابل درمان باشند باید پیش از ART تحت درمان قرار داد .اما درصورتی که این ناهنجاری ها قابل درمان نبوده یا درمان های قبلی با شکست مواجه شده اند باید (Gestational Surrogacy(GS را مد نظر داشت .مثال کلاسیک GS بعد از هستروکتومی بدون اووفورکتومی یا آژنزی مولرین است.دربیماری که قبلاً عقیم شده، تخمدان های طبیعی با ذخیره باقیمانده تخمدانی طبیعی وجود دارند اما اگرحاملگی وجود ندارد،انتقال اووسیت بارور درمحیط invitro که پس از
تحریک تخمدانی از زنی که پذیرش رحمی در او وجود،نداشته یا کاهش یافته به یک میزان آماده و سنکرونیزه کاملاً موافقت آمیز است.
عدم انطباق جنینی -مادری
Gestational surrogacy را ممکن است برای زن باروردیگری که در صورت بارداری درخطر مشکلات طبی قرار دارد مد نظر قرار داد.مثال هایی از این دست شامل هیپرتانسیون شدید،دیابت شدید و بیماری قلبی شدید مادر است. surrogacy همچنین پاسخ به مسائلی است که جنین در معرض خطراتی که توسط ما درانتقال می یابد قرار می گیرد. مثلاً در مورد حساسیت Rh،شیمی درمانی مادری یا سقط های راجعه این مشکلات تحت عنوان عدم انطباق جنینی -مادری طبقه بندی می شوند.استفاده ازاین فن آوری ها برای اندیکاسیون هایی غیرازیک اندیکاسیون روشن طبی،مانند مادری که آرزو می کند کودکی ژنتیکی داشته باشد اما نمی خواهد دوران بارداری را طی نماید مورد استفاده قرار می گیرد.
سیگنال دهی جنینی
سیگنال های بیوشیمیایی ازآندومتر به پیش رویان و از پیش رویان به آندومتر که کاشت را تحت تأثیر قرار می دهند ناشناخته اند.کاندیداهای متعددی از قبیل فیبرونکتین انکوفتال،انتگرین ها،فاکتورفعال کننده پلاکتی و PAPP-A برای سیگنال های کاشت درنظرگرفته شده و مورد مطالعه قرار گرفته اند.این موارد ممکن است برای بررسی سلامت جنینی مورد ارزیابی قرار گیرند اما نکته مهم تر این است که بررسی ونتیجه گیری های حاصل از این موارد امکان بهبود یا تغییر کاشت را مهیا می سازد.
اهداف فن آوری تولید مثل
فن آوری تولید مثل با سرعت و توانی به صورت نامتوازی با پیشرفته های پزشکی گسترش یافت.علوم پایه و بالینی در این مقوله با سرعتی سرسام آور توسعه یافتند به نحوی که موارد مرتبط اجتماعی، اخلاقی و قانونی به میزان زیادی از آن جا ماندند.تلاش های گسترده در استرالیا، اروپا و ایالات متحده از طریق انجمن طبی تولید مثل آمریکا (ASRM) سعی در تدوین و روز آمد کردن این مباحث نمودند.بورد اخلال پزشکی در زمینه تولید مثل به کالج آمریکایی مامایی و زنان و ASRM ملحق شد.
موارد رویان های منجمد،مایع منی منجمد، مرگ های جنینی های مصنوعی،نحوه پرداخت وجه به اهداء کنندگان اووسیت، بیوپسی رویان،انتخاب جنس،کلونینگ و تبلیغات مرتبط با این حوزه ازجمله نکات مورد بحث در دنیای درمان های کمک باروری هستند. براساس Gestational Surrogacy،تعریف مادر بودن به دو نوع جداگانه مادر ژنتیکی (genetic mother) و مادر والد(birth mother) تقسیم می شود.با فن آوری های جدید این امکان فراهم آمده است که مادر بزرگ ها بتوانند نوه هایشان را به جای دخترانشان در رحم خود پرورش داده وزنان یائسه از طریق اووسیت های اهدایی باردار شوند.
این پیشرفت های علمی سبب سردرگمی های اجتماعی فراوانی شده است.آژانس های مرتبط،دولت ها،شرکت های بیمه و دریافت کنندگان خدمات درگیر این مشکلات بوده و ممکن است این تداخل با پیشرفت های علمی ادامه یابد.برای به حداقل رسانیدن این مشکلات باید دید حرفه ای را در این زمینه افزایش داد.
اهداف طبی را باید در مورد هر زوج با نیازهای مربوطه ارزیابی و از میان فن آوری های در دسترس بهترین را انتخاب نمود تا مطلوب ترین روش تولید مثل زیستی مورد استفاده قرار گیرد.ما نمی توانیم به جهت در مورد ابتلا به یک بیماری طبی شناخته شده می توان از بکارگیری نادرست این فن آوری ها اجتناب نمود.Backlash چنین مواردی را پیگیری می نماید.تنها بر اساس بررسی های علمی معتبرو استفاده بالینی کنسرواتیو و مجوزهای قانونی باید به انجام چنین روش هایی در مورد زوج هایی که نیازمند این روش ها هستند،پرداخت.
تکنیک ها در حال تکاملند و کشفیات ادامه دارند.این دستکاری ها،ژن درمانی و بهبود دانش ما نسبت به باروری و
کاشت،گستره هایی در حال رشدند.ما به عنوان ارائه دهندگان خدمات بهداشتی باید مطمئن شویم که این پیشرفت ها در برگیرنده مسائل طبی و اجتماعی توامان هستند.
منبع:مامایی وبیماریهای زنان دنفورث،جلد دوم.
/ج