ازدیاد آندروژن
Androgen Excess
ازدیاد آندروژن،وضعیت پاتولوژیکی در زنان است که درابتدا به صورت عضلانی شدن بدن بروزمی کند.پرمویی رایج ترین عارضه ای است که به همراه ازدیاد آندروژن مشاهده می شود.این حالت به رشد موهای ضخیم زائد،با رنگ تیره درنواحی پوستی وابسته به آندروژن اطلاق می شود. پرمویی اغلب با آکنه های معمولی که در اثر تحریک آندروژنی غدد سباسه بوجود آمده،همراه است.مازاد بودن رویش مو را با توجه به شاخص های فرهنگی و نژادی در نظر می گیرند.ازدیاد آندروژن،معمولاً در شرایط ناباروری،اختلالات قاعدگی و تخمک گذاری نامناسب حاصل می شود. شدیدترین حالت ازدیاد آندروژن را تحلیل صفات زنانه و کسب صفات مردانه،یعنی حالت مردنمایی می نامند.پرمویی شدید، ریزش موها با الگوی مردانه،آکنه و افزایش توده عضلانی بدن ازعلائم و نشانگان مردنمایی هستند.مردنمایی همیشه با وضعیت ازدیاد آندروژن و گاهی با نئوپلاسم همراه است.در این مقاله ساخت و متابولیزم استروئیدهای آندروژنی،نقش فیزیولوژی و غیرفیزیولوژی آنها،تشخیص های بالینی و درمان بیماران مبتلا به ازدیاد آندروژن،مرورشده است.
آندروژن ها
آندروژن ها ترکیبات منحصربه فردی با ساختمان استروئیدی هستند که بطورطبیعی بروزخصوصیات اولیه و ثانویه را در هر دو جنس تحریک می کنند.آندروژنها در زمان زندگی رحمی،سبب تکامل مجاری تناسلی مردانه می گردند.این تکامل در اوایل هفته ششم بارداری،درپاسخ به ترشح بیضه ای آندروژنها آغاز می گردد. با تحریک آندروژنی مجرای ولف(مزونفریک)، اپیدیدیم،رگ وابران و کیسه منی شکل می گیرند.ادامه ترشح آندروژن از سلولهای لیدیگ بیضه جنین،سبب تمایز توبرکل جنسی و سینوس ادراری تناسلی به آلت،تناسلی، کیسه بیضه و مجرای ادرار می شوند. آندروژنها درهردو جنس آغاز گر بروز صفات ثانویه جنسی می باشند.افزایش ترشح تستوسترون و دی هیدروتستوسترون باعث تکمیل بلوغ ظاهری وفیزیولوژی مجرای تناسلی در مردان می شود.این هورمون ها به همراه آندروژنهای فوق کلیوی،رشد موهای وابسته به بلوغ مردانه را تحریک می کنند.آندروژنهای فوق کلیوی در زنان ابتدا به عنوان محصولات فرعی در روند تبدیل آنزیمی کلسترول به کورتیزول در ناحیه رتیکولار ساخته می شوند.این آندروژنها رشد موهای وابسته به بلوغ را در ناحیه عانه و زیر بغل تحریک می کنند.آندروژنهای مشتق ازاستروما و پوشش تخمدان ها پیش ساز اجباری در ساخت استروژن ها محسوب می شوند.آروماتیزه شدن آندروژنها به استروژنها با واسطه هورمون فولیکوتروپین انجام می پذیرد.
استروئیدزایی
استروئیدزایی درپاسخ به هورمونهای تنظیمی خاصی دربافت های ویژه ای انجام می پذیرد.به عنوان مثال،کورتیکوتروپین، تنظیم کننده تولید کورتیزول فوق کلیوی،با اتصال به گیرنده سطح سلولی خود،سبب فعال شدن آنزیم آدنیلات سیکلازو تولید AMP حلقوی می شود.با این عمل در نهایت کلسترول آزاد ساخته می شود.در غده فوق کلیه گیرنده خاصی به مجموعه کلسترول و لپیوپروتئین (لیپوپروتئین با دانسیته کم)متصل می شود و آن را به کلسترول و یا فرم استری آن تبدیل می کند. کلسترول یعنی استرولی 27 کربنه ساختمان مشترک تمام استروئیدها (گلوکوکورتیکوئیدها،
مینرالوکورتیکوئیدها،استروئیدهای جنسی) را تشکیل می دهد.درمسیری آنزیمی با کنترل هورمونی،کلسترول درفوق کلیه و تخمدان ها به استروئیدها تبدیل می شود. این تبدیلات آنزیمی در سیتوپلاسم، میتوکندری و میکروزوم های سلولی بافت های خاصی انجام می پذیرد.درمتابولیزم کلسترول،اولین مرحله که مرحله کنترل کننده نیزهست،تبدیل کلسترول به پرگننولون 21 کربنه است.این عمل درطی فرآیند های هیدروکسیله شدن با جدا شدن زنجیره جانبی انجام می پذیرد.پرگننولون از یکی از دو مسیر دلتا 4 و یا دلتا 5 به آندروژن های 19 کربنه تبدیل می شود.محصولات اصلی مسیردلتا4،تستوسترون و آندرواستن دیون و محصولات مسیردلتا 5،دهیدرواپی اندروسترون و آندروستن دیول(دی هیدروتستوسترون نیز نامیده می شود)می باشند.جایگاه های مختلفی مانند کربن 17،کربن 3 و کربن 7 در ساختمان مولکولی آندروژن های 19 کربنه توان و اثر آندروژنی آنها را تعیین می کنند.تبدیل گروه کتونی کربن شماره 17 در آندروستن دیون به گروه 17-بتا هیدروکسیل در تستوسترون،خاصیت آندروژنی آن را 7 برابرافزایش می دهد.با تشکیل گروه کتونی در کربن شماره 3،دهیدرواپی اندروستن دیون به اندروستن دیون تبدیل می شود. افزایش یک هیدروژن به کربن 5، تستوسترون را به دی هیدروتستوسترون تبدیل می کند و اتصال به گیرنده سیتوپلاسمی و توان آندروژنی آن را افزایش می دهد.آندروژنها درسرم به همراه چندین پروتئین اتصالی توزیع می شوند و این پرتئین ها در متابولیزم و اثرات آندروژنی آنها نقش بازی می کنند.این پروتئین ها شامل :آلبومین،گلوبولین کورتیزول گیر،الفادوگلیکوپروتئین و گلوبولین متصل شونده به هورمون هی جنسی می باشند.هرچند آلبومین در مقایسه با گلوبولین متصل شونده به هورمون های جنسی،ظرفیت اتصالی بیشتری را داراست، اما تمایل تستوسترون برای اتصال به این گلوبولین 100000 بیشتر از تمایل اتصال به آلبوبولین می باشد.بیشترین میزان تستوسترون در پلاسما به گلوبولین گیرنده هورمون های جنسی ،متصل است و این پروتئین تعیین کننده اصلی میزان هورمون آزاد و دسترسی بافت های حساس به تستوسترون سرمی می باشد.این پروتئین در کبد ساخته می شود و میزان تولید آن توسط آندروژنها،درزمان یائسگی،چاقی و کم کاری تیروئید،کاهش می یابد.درشرایط پرکاری تیروئید و تحت اثر استروژن ها، ساخت این پروتئین افزایش پیدا می کند. میزان بروزاثرات آندروژنی هم به تولید استروئیدها و هم پاسخ دهی بافتی بستگی دارد.درهفته 12 تا 22 بارداری میزان توده عضلانی،پاسخ دهی بافتی،توان تبدیل تستوسترون به دی هیدروتستوسترون (توسط 5 آلفاردوکتاز)و برآمدگی جنسی در جنین هردو جنس یکسان می باشد.بنابراین جنین مذکرتوسط تستوسترون بیضوی خود، از جنین مونث متمایز می شود.درغیاب تستوسترون و یا گیرنده ناکافی،علیرغم کامل بودن کروموزوم ها،دستگاه تناسلی به فرم مونث شکل می گیرد.جنین مونث،توان پاسخ دهی به تحریکات آندروژنی را بعد از تولید حفظ می کند و لذا در حضور مقادیر فیزیولوژیک آندروژن ها،پوست عضلات، حنجره و سیستم ادراری تناسلی می تواند تا حدود زیادی به فرم مذکرشکل گیرد.
الگوها ی مو
فولیکول های مو وغدد سباسه از ضمائم حساس به آندروژن در ساختمان پوست محسوب می شوند.فولیکول های مو قادر به تشکیل کرک های ظریف و موهای نهایی هستند.کرک ها ظریف،کوتاه و کمرنگ هستند در حالی که موهای نهایی تیره،بلند و قطور می باشند.سطح بالای آندروژن ها که بطور طبیعی درمردان و غیرطبیعی در زنان یافت می شود،سبب تبدیل کرک های ظریف به موهای نهایی دراندام هایی مانند صورت، جناغ سینه،پشت و بالای شکم می شوند.
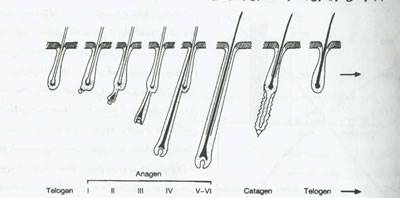
فولیکول های مو در ناحیه زیر بغل، مثلث عانه، ساعدها و پاها در زنان به میزان کم آندروژن مانند میزان بالای آندروژن در مردان پاسخ می دهند.فقدان و یاکم پشتی مو در این نواحی در مردان که بصورت ارثی به آندروژن ها کاملاً مقاومت دارند(مانند زن زایی بیضه ای )دیده می شود.موهای سر در ابتدا مستقل ازتحریک آندروژنی رشد می کنند.به هرحال درغلظت بالای آندروژن ها این اثر تحریکی معکوس شده و سبب تبدیل مو به کرک و یا ریزش کامل مو در برخی ازنواحی پوست سر می شود.به جز این ناحیه که نسبتاً مستقل از آندروژن است،فولیکول های مو برای تبدیل شدن به موهایی نهایی باید برای مدتی در معرض آندروژن ها قرار گیرند.ازآندروژن است، فولیکول های مو برای تبدیل شدن به موهایی نهایی باید برای مدتی در معرض آندروژن ها قرار گیرند. طرف دیگر رشد موهای نهایی بعد از حذف منبع آندروژن ها با سرعت کمترادامه می یابد.رشد مو فرآیندی مداوم نیست،بلکه چرخشی بین سه فاز فعالیت فولیکول می باشد.مرحله رشد فولیکول را آناژن،مرحله استراحت را تلوژن و مرحله بینابینی را کاتاژن می نامند(شکل2).تمام فولیکول ها پیوسته بین این سه مرحله در چرخش هستند و بنابراین موها دائماً درحال ریزش و رشد هستند. مدت زمانی که یک فولیکول مو در هر یک از این مراحل سپری می کند به جایگاه آناتومی آن بستگی دارد.موهای کوتاه انگشتان، ابروها و مژه ها مدت کوتاهی در مرحله آناژن (2 تا 4ماه) و بیشترین مدت را در مرحله تلوژن می گذرانند.ازطرف دیگر موهای بلند سر،زمانی طولانی را در مرحله آناژن (1تا6 سال) درنواحی پاسخ دهنده، سبب راندن فولیکول به مرحله آناژن و طولانی شدن این مدت و ازدیاد موهایی نهایی می شوند.درطی مرحله آناژن،کاهش رشد اپیتلوم ازساقه مو به سمت پیاز فولیکول مو درپوست اتفاق می افتد.سلول های شبکه به سرعت به سوی سطح پوست رشد کرده و سلول های شبکه به سرعت به سوی سطح پوست رشد کرده و سلول های شبکه فوقانی به ستون های گراتینه شده تمایزمی یابند.پیاز فولیکول مو دراطراف پاپی پوستی تشکیل می شودو تا زمان ریزش آن درمرحله کاتاژن می باشد.اگر این فولیکول برای رشد بیشترتحریک نشود در مرحله تلوژن باقی می ماند.درمرحله استراحت،این مو اتصال سستی به فولیکول دارد و به سادگی می ریزد.
منابع و متابولیزم آندروژن ها
تستوسترون،دی هیدروتستوسترون، آندرستن،دیون،دهیدرواپی اندروسترون و دهیدرواپی اندروسترون سولفات مهمترین آندروژهای زنان و مردان هستند.دی هیدروتستوسترون با توان دو برابر نسبت به تستوسترون،قویترین آندروژن محسوب می شود.سنجش دی هیدروتستوسترون سرمی،شاخص بالینی خوبی برای ازدیاد آندروژن محسوب نمی شود.این ترکیب بسرعت ازسرم پاکسازی می شود و اتصال بسیار محکمی با گلوبولین گیرنده هورمون های جنسی (SHBG) دارد.دی هیدروتستوسترون (DHT) عمدتاً در بافت های محیطی خصوصاً در پوست از آندروستن دیون ساخته می شود.میزان دی هیدروتستوسترون در پلاسما دستخوش تغییرات روزانه و یا قاعدگی نمی شود.
کل 3. نمایه چرخه فولیکول. ساختمان مو (تصویرسفید) در انتهای تلوژن و ابتدای آناژن فولیکول (I-IV) یک موی جدید (تصویر سیاه) در ابتدای آناژن فولیکول (V-VI).
Mauvais-Jarvis نشان داد که فعالیت آنزیم 5 آلفا ردوکتاز در پوست زنان مبتلا به پرمویی نسبت به سایر زنان بیشتر است لذا تولید DHT درآنان افزایش می یابد. Lobo و همکارانش با اندازه گیری متابولیت های DHT نشان دادند که میزان 3 آلفا آندروستن دیول گلوکورونید (a-diol G) در زنان پرمو نسبت به زنانی با تخمدان چند کیستی (PCOS) که پرمو نیستند بیش از ده برابر افزایش دارد.این افزایش شدید در پرمویی هایی با منشاء نامشخص (در غیاب علل مشخص پرمویی مانند PCOS) نیزیافت شده است.همین محقق و همکارانش ارتباط تنگاتنگی بین فعالیت آنزیم 5 آلفاردوکتاز پوستی و میزان a-diol G -3سرمی را گزارش کرده اند. البته مطالعات بعدی که در مقاله مروری Rittmaster آورده شده،اختلاف شدید میزان a-diol G-3 را در زنان پرمو وغیر پرمو نشان نداده است.بعلاوه سایر مطالعات کاهش میزان a-diol G-3 را در زنان پرمویی که با مشابهات هورمون رها کننده گنادوتروپین تحت درمان قرار گرفته اند،تایید نکرده اند.بجزچند استثناء، میزان DHT و a-diol G-3 سرمی به تشخیص و یا درمان ازدیاد آندروژن،کمک چندانی نمی کند.
دومین آندروژن مهم تستوسترون است. حدود یک درصد تستوسترون در زنان و حدود 3 درصد این هورمون در مردان بصورت آزاد و غیر متصل به SHBG وجود دارد.در هر دوجنس حدود 19 درصد از تستوسترون اتصال سستی به آلبومین دارد.بسته به مرحله چرخه قاعدگی بین 5 تا 20 درصد تستوسترون در زنان منشاء تخمدانی دارد.ازآنجایی که غده فوق کلیه مستقیماً میزان کمی تستوسترون تولید می کند،این هورمون به عنوان شاخص تخمدانی ازدیاد آندروژن استفاده می شود.بیش از 50 درصد تستوسترون از تبدیل محیطی آندروستن دیون دربافت هایی نظیر کبد، پوست،چربی و عضلات ساخته می شوند. سطح سرمی تستوسترون تغییرات روزانه خفیفی به موازات ترشح کورتیزول دارد. دی هیدروتستوسترون و آندروستن دیون به ترتیب از احیاء کربن شماره 5 در تستوسترون و آندروستن دیون ساخته می شوند.تستوسترون و دی هیدروتستوسترون هردو درحد نانومولار در خون وجود دارند اما میزان متابولیت های آنها یعنی مزدوج های گلوکورونیده و سولفاته به ترتیب 10 و 100 برابر بیشتر می باشند.آندروستن دیون می تواند بالقوه به تستوسترون تبدیل شود اما برای تشکیل استرون حتماً باید ازحد واسط آندروستن دیون گذشت.حدود 20 درصد تستوسترون از آندروستن دیون ساخته می شود.میزان تولید تخمدانی و فوق کلیوی آندروستن دیون تقریباً یکسان است.حدود 10 درصد از آندروستن از تبدیل محیطی دهیدرواپی آندرواسترون ساخته می شود.بدنبال تحریک فوق کلیوی با ACTH،میزان آندروستن دیون می تواند تغییرات روزانه 50 درصدی داشته باشد.دروسط دوره قاعدگی نیز میزان این ترکیب تا حدودی افزایش می یابد.ازآنجایی که فعالیت آندروژنی DHEA و DHEA-S کمتر از3 درصد فعالیت تستوسترون است،این ترکیبات آندروژن های ضعیفی محسوب می شوند و بهتر است آنها را پیش هورمون نامید.فعالیت آندروژنی این ترکیبات بدلیل محیطی آنها به آندروژن های قوی تر،خصوصاً در فولیکول موها مربوط می شود.بیش از 85 درصد از DHEA و 95 درصد DHEA-S از فوق کلیه ترشح می شود و سهم تخمدان ها در این مورد بسیارناچیزاست.سطح سرمی DHEA از DHEA-S بیشتراست و میزان آن به موازات کورتیزول تغییر روزانه دارد.
نشانگان ازدیاد آندروژن
تحریک غدد مو-سباسه با آندروژن ها و گسترش پرمویی و آکنه از نخستین علائم ازدیاد آندروژنی محسوب می شوند.حدود 90% از زنان پرمو،یک یا چند آندروژن را بیش ازحد تولید می کنند.درجدول 1 فهرستی از علل مختلف ازدیاد آندروژنی ارائه شده است.
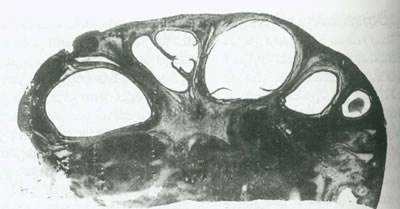
شکل 4: سندرم تخمدان پلی کیستی:این تصویر منظره کاملی از بخش بالایی یک تخمدان پلی کیستی است که نشان دهنده کیست های فولیکولی متعدد در زیر یک استرومای ضخیم شده می باشد.ناف تخمدان برجسته است.ضخیم شدن آشکار کپسول باعث متراکم شدن استرومای قشری بین فولیکولهاست.
جدول 1:علل ازدیاد آندروژنی
|
علل عملکردی تخمدان
نشانگان تخمدان چند کیستی،چاقی،مقاومت به انسولین،آکانتوزیس نیگریکانس، هیپرتکوز،
نئوپلاستیک :
تورمورهای سلول های لایدیگ -سرتولی، تومور لیپیدی،تومورسلول های هیلوس، لوتما و غیره .
علل عملکردی فوق کلیه :
هیپرپلازی مادرزادی فوق کلیه،هیپرپلازی اکتسابی فوق کلیه
نئوپلاستیک :
تومور فوق کلیه،کارسینومای فوق کلیه، بیماری و یا نشانگان کوشینگ
علل مختلف تخمدانی -فوق کلیوی :
دارو درمانی،ازدیاد تولید محیطی آندروژنها،دیس ژنزی تخمدانی XY
|
ازدیاد آندروژنی با منشا تخمدانی
نشانگان تخمدان چند کیستی
رایج ترین علت ازدیاد آندروژنی با منشاء تخمدانی و نیز پرمویی درزنان،تخمدان های چند کیستی می باشد.بنابه اظهارات Goldzieher و Axelrod 70% شیوع پرمویی در زنان به علت تخمدانهای چند کیستی می باشد.ظاهراً تخمدان های چند کیستی در انتهای طیفی از ناهنجاری های فیزیولوژیکی بوجود می آیند، علایمی مانند پرمویی،عدم تخمک گذاری و ناباروری در بیش از 50% رنان مبتلا به نشانگان تخمدانی چند کیستی مشاهده می شود. عوارضی مانند چاقی،مردزایی و اختلالات قاعدگی نیزبا شیوع متفاوتی دیده می شود. همانطور که در شکل 4 مشاهده می شود، ازلحاظ بافت شناسی تخمدان چند کیستی، دارای حفره های کوچک متعددی است که سلول های گرانولوزا در آن بخوبی تکامل نیافته اند.
فولیکول با لایه ضخیمی از سلول های تکا محاصره شده است.پارامترهای بیوشیمیایی که قادر به تعیین و تعریف وضعیت تخمدان چند کیستی باشند به خوبی مشخص نشده اند.بیماران مبتلا به نشانگان،اغلب دارای میزان افزایش یافته ای از تستوسترون، دهیدرواپی اندرواستن دیون سولفات و پرولاکتین می باشند.دراین افراد اغلب نسبت E2(استرادیول) به E1 معکوس شده و نسبت LH به FSH برابر 3:1 و یا بیشتر خواهد بود.براساس یافته های آناتومیکی و فیزیولوژیکی،تئوری های مختلفی جهت توضیح بیوشیمیایی ناهنجاری های مربوط به تخمدان چند کیستی ارائه شده است.در این افراد میزان LH عموماً بالاست و پاسخ دفعات و شدت رهایی LH به GnRH هیپوتالاموسی بیش ازحد طبیعی است.از آنجایی که GnRH مهمترین محرک رهایی گنادوتروپین ها است،اختلال در کنترل رهایی این هورمون
می تواند توجیه کننده تخمدان های چند کیستی باشد.متاسفانه سنجش GnRH در خون محیطی کار ساده ای نیست،حتی در صورت اندازه گیری،ارتباط دادن آن به فعالیت هیپوتلاموس نیز سوال برانگیز خواهد بود.درحیوانات واسطه عصبی دوپامین ترشح GnRH هیپوتالاموسی را مهار می کند.مطالعات زیادی نشان داده است که اختلال رابطه دوپامین و GnRH، سبب افزایش شدت و دفعات رهایی GnRH می شود.اپیوئیدهای (Opioids) مرکزی نیز اثرمهاری بر ترشح GnRH داشته و میزان دوپامین را نیزتنظیم می کند.به همین دلیل اختلال ریتم اپیوئیدها می تواند سبب اختلال در ترشح GnRH باشد.مطالعات با تزریق نالوکسان نشان داده است که پاسخ اپیوئیدها در تخمدان چند کیستی سالم و دست نخوره می باشد،و لذا اختلال در مسیر بر هم کنش اپیوئیدها و دوپامین می باشد. واضح است که برای حل مشکل PCOS نیاز به اطلاعات بیشتری است.به هرحال افزایش LH و کاهش FSH وجود دارد. احتمالاً ترشح FSH تحت تاثیر اینهیبین (Inhibin) تولیدی ازکیست های تخمدانی قرار دارد.نتیجه افزایش نسبت LH به FSH،تولید زیاد تستوسترون و آندروستن دیون تحت تاثیر LH توسط سلول های تکا و استروما درتخمدان ها می باشد.درغیاب میزان کافی از FSH،آروماتیزه شدن تستوسترون و آندروتسن دیون به استرادیول در سلول های گرانولوزا کاهش می یابد.براساس گزارش اریکسون و همکارانش، تولید استرادیول توسط سلول های گرانولوزای کشت داده شده ازکیست های PCOS کاهش یافته است و با افزایش FSH به محیط کشت مذکور،تولید استرادیول بشدت افزایش می یابد. آندروژن های تخمدانی دربافت های محیطی تبدیل به استروژن ها می شوند.استروژن ها بطورمزمنی در بیماران PCOS که فاقد تخمک گذاری هستند افزایش یافته اند. سیکل با ترشح مداوم LH هیپوفیزی که تحت تاثیر مقادیرافزایش یافته آندروژن است کامل می شود.
هیپرتکوز
هیپرتکوز شباهت زیادی به علائم بالینی PCOS دارد اما میزان پرمویی شدیدتر بوده و اغلب با علایم مردانگی همراه است.از نطر بافت شناسی،این سندرم شباهت زیادی به PCOS دارد.درتخمدان های هیپرتکوز جزایر متعددی ازسلول های لوتئین پراکنده در استروما و نزدیک ناف تخمدان دیده می شوند.گاهی افزایش میزان آندروژن ها در حد مبتلایان به تومورهای ترشح کننده آندروژن بوده،لذا تخمک گذاری در این بیماران بسیار مشکل است.جهت حفظ باروری،اغلب برداشتن گوه ای بخشی از تخمدان انجام می گیرد اما گاهی لازم است که تخمدان بطورکامل برداشته شود.
چاقی،مقاومت به انسولین و آکانتوزیس نیگریکانس
مشکلات متعدد بهداشتی هم از نظر عمومی و نیز از لحاظ عوارض ویژه بیماری های زنان،با چاقی همراه است.نامنظمی دوره قاعدگی،آمنوره،خونریزی و اختلال عملکرد رحم از این جمله محسوب می شوند. علیرغم اینکه بسیاری از زنان چاق دارای قاعدگی طبیعی هستند،اما با افزایش وزن، درصد زنان با قاعدگی نامنظم افزایش می یابد.kaufman و همکارانش افزایش آندروژن ها و LH و معکوس شدن نسبت E2:E1 را دختران بالغ چاق نشان دادند. این یافته ها که بیاد آورنده PCOS هستند، با کاهش وزن قابل برگشت می باشند. درزنان چاق میزان تولید و نیز پاکسازی آندروژن ها افزایش می یابد.دراصل کاهش SHBG ( گلوبولین گیرنده هورمون های جنسی)سبب افزایش پاکسازی آندروژن ها می گردد اما بطور همزمان میزان آزاد تستوسترون بالا می رود.افزایش وزن با افزایش آروماتیزه شدن آندروژن ها و تبدیل به استروژن ها مرتبط است.
افزایش میزان آندروژن ها و نیز افزایش نسبت E2:E1 و کاهش SHBG،شرایط بیوشیمیایی را فراهم می کند که در وضعیت PCOS دخالت دارند.بیش از نیمی از مبتلایان به PCOS چاق هستند و کاهش وزن می تواند سطح آندروژن ها و پرمویی را کاهش دهد.کاهش وزن حتی در برخی از زنان مبتلا به PCOS سبب برگشت تخمک گذاری می گردد.
در چاقی،خصوصاً زمانی که با PCOS همراه است،افزایش انسولین،مقاومت به انسولین و تست تحمل گلوکزغیرطبیعی دیده می شود.سطح بالای آندروژن ها به همراه افزایش انسولین با افزایش رنگدانه های پوست درنواحی گردن،زیربغل، داخل مهبل و زیر پستانها همراه می گردد.به این وضعیت اکانتوزیس نیگریکانس گویند.این عوارض به عنوان نشانه مقاومت به انسولین خصوصاً در بانوانی که مبتلا به دیابت ملیتوس غیروابسته به انسولین هستند،محسوب می شوند.رابطه میان افزایش آندروژن ها و میزان انسولین ،در حال آشکارشدن است.
انسولین متعلق به خانواده ای از پپتیدهاست که فاکتورهای رشد شبه انسولین خوانده می شوند.IGF-1 (فاکتور رشد شبه انسولین1) سبب افزایش تولید آندروژن ها توسط سلول های پوششی تخمدان می شود. بدلیل شباهت گیرنده های انسولین و IGF-1، این هورمون در محیط کشت سبب افزایش تولید تستوسترون و آندروژن های آروماتیزه توسط سلول های پوششی و استرومای تخمدان ها می شود.
کاهش مقاومت به انسولین و کاهش میزان انسولین سبب کاهش آندروژن ها می گردد و این امرارتباط بین انسولین و آندروژن ها را تقویت می کند.احتمالاً در PCOS، مقاومت به انسولین می باشد و از لحاظ ژنوتیپی با سایر موارد مقاومت به انسولین متفاوت است.چاقی به دو فرم زنانه و مردانه طبقه بندی می شود.چاقی زنانه با توزیع چربی در مناطق باسن ها و ران ها همراه است و واژه شبه گلابی برای این زنان چاق بکار برده می شود.چاقی مردانه، با توزیع چربی در تنه و شکم مشخص می شود و شبه سیب خواند می شود.در زنانی که دارای این نوع توزیع چربی می باشند،خطرابتلا به بیماری قلبی عروقی بیشتر است.کتابچی (Kitabchi) و Burington گزارش کرده اند که در زنان با چاقی شکمی در مقایسه با زنانی با چاقی باسن وران،میزان آندروژن های بالاتر، مقاومت به انسولین و تولید پایه و وابسته به گلوکز بیشتری ازانسولین دارند.همچنین در گروه اول کلسترول، LDL وفشارخون بالاتراست.لذا توصیه می شود زنان چاق دارای علائم PCOS با رژیم غذایی و ورزش،وزن خود را کنترل کنند و از نظر اختلال در لیپیدهای خون و مقاومت به انسولین غربال شوند.
نئوپلاسم های تخمدانی
نئوپلاسم های تخمدانی که با افزایش آندروژن ها همراه باشند،نادرهستند.اگراین نئوپلاسم ها درسن باروری دیده شوند اغلب با آمنوره،هیرسوتیزم و مردنمایی پیشرونده همراه خواهند بود.
شایعترین تومورهای ایجاد کننده حالت مرادنه تومورهای سلول های پوشش گنادها می باشند.تومورسلول سرتولی - لیدیگ (آرنوبلاستوما)شایعترین توموراین گروه محسوب می شود.بطورمشخص این تومور درزنان 30-20 ساله شایعتراست اما گزارشهایی مبنی بر وجود آن دریک دختر 2/5 ساله ونیز یک زن 70 ساله وجود دارد.دراین بیماران معمولاً دوره های قاعدگی متوقف شده و رشد مو سریع است. تومورها مشخصاً یک طرفه بوده و در معاینه لگن قابل لمس می باشند،همچنین این تومورها مقادیرزیادی تستوسترون تولید می کنند،بطوری که میزان این هورمون در خون محیطی به بیش از 200ng/dl می رسد(یعنی درحد مردان طبیعی). تومورهای سلول نافی و سلول های پوششی گنادهای مختلط (مانند Gyneandroblastoma) دو نئوپلاسم دیگرسلول های پوششی گنادها هستند که بالقوه قادربه ایجاد مردنمایی می باشند. تومورهای سلول نافی و سایر تومورهای سلول های چربی معمولاً غیر قابل لمس هستند و مبتلایان به این بیماری،احتمالاً با تظاهر پرمویی بدنبال توقف قاعدگی مواجه می باشند.
سایرتومورها نیز ممکن است سلول پوششی را تحریک کرده و منجر به تولید اندروژن اضافی گردند که عبارتند از:دیس ژرمینوما، تراتوما،تومور Brenner، سیستادنومای سروزی و تومور Krukenberg.این تومورها بطورمشخص همراه با تولید فراوان آندروژن های اروماتیزه می باشند.
تومور سلول های گراف تخمدانی که یک تومور بالقوه می باشد،دردوران بارداری نادر است و می تواند بر مادر و جنین تأثیر بگذارد.این تومورمعمولاً حالت سفت و دو طرفه دارد که برخی نشانه های سلولی آن از نظر بافت شناسی مشابه کیست های حاملگی پوششی زرده ای (تکا-لوتئین) است که همیشه دو طرفه اند.اما تاکنون گزارشی از ایجاد مردنمایی در مورد آنها وجود ندارد.مردنمایی یا پرمویی در زمان حاملگی ممکن است به علت هر یک از تومورهای شرح داده شده ایجاد گردد.
علل آدرنالی ایجاد آندروژن اضافی
هیپرپلازی آدرنال ارثی
غده آدرنال (به تنهایی یا همراه با تخمدان) در بسیاری از مطالعات بعنوان منبع اصلی افزایش تولید آندروژن ها و هیپراندروژنیسم در زنان مبتلا به پرمویی گزارش شده است.شایعترین نقص آنزیمی در ایجاد آندروژن اضافی،کمبود 21-هیدروکسیلاز بوده که عامل ایجاد هیپرپلازی آدرنال ارثی 21 یا CAH21 است که نام دیگر آن CAH نوع III می باشد.این عارضه که معمولاً هنگام تولد مشخص می شود با دو جنسی بودن نوزاد و در موارد نادرتر با کمبود شدید نمک،کاهش فشارخون و شوک همراه است.دردختر بچه ها یا پسربچه های مبتلا و درمان نشده امکان القای صفات مردانه و مردنمایی زودرس وجود دارد.
علاوه بر درمان با گلوکوکور تیکوئیدها که برای دختران و پسران انجام می شود،در دخترانی که عوارض شدیدی دارند. جراحی اصلاح جنسی نیز انجام می گیرد.
نقص CAH21 منجر به عدم توانایی غده فوق کلیه درساخت مقادیرکافی گلوکوکورتیکوئیدها و مینرالوکورتیکوئیدها می گردد.دراین وضعیت ACTH افزایش یافته و موجب تولید فراوان پیش سازهای هورمون های فوق کلیوی می شود. افزایش بارز 17-هیدروکسی پروژسترون (OHP-17) (پیش ساز کورتیزول و آندروژن ها)درCAH21 دیده می شود.همچنین مقدار 17-OHP تا حد قابل تشخیص در مایع آمنیوتیک جنین و نیز در سرم نوزادان یا کودکان مبتلا افزایش می یابد.نقص CAH21 معمولاً با افزایش DHEA و نیز DHEA-S همراه است.
کمبود 11-بتاهیدروکسیلاز(CAH-11)(11B-OHیا CAH نوع IV) یکی دیگراز عوامل ارثی افزایش آندروژن ها است. مانند CAH21 این نقص نیز مانع تبدیل پیش سازها به کورتیزول می گردد و لذا میزان کورتیزول کافی نیست لذا ACTH تحریک شده و باعث افزایش تولید پیش سازهای هورمون های گلوکورتیکوئیدی، مینرالوکورتیکوئیدی و اندروژن ها می شود.
11-دزوکسی کورتیکوسترون (یک مینرالوکورتیکوئید قوی)بمقدارزیاد ساخته می شود و معمولاً با احتباس نمک سبب افزایش فشارخون می گردد.افزایش 11-دزوکسی کورتیزول سرم علامت تشخیصی CAH-11 است.کاهش مقدار آنزیم 3- بتا هیدروکسی استروئید دهیدروژناز 5-4 ایزومراز (CAH,CAH-3 hsd نوع II) منجر به کاهش گلوکوکورتیکوئیدها، مینرالوکورتیکوئیدها و استروئیدهای جنسی می شود.این عارضه کمیاب،سبب تظاهرات بالینی ازدست دادن نمک و عدم ایجاد مردانگی طبیعی در نوزادان مذکر می گردد. بچه های مونث که به دوران کودکی می رسند به علت کمبود تولید E2 صفات ثانویه جنسی را ظاهر نمی سازند اما بعلت تولید DHEA فراوان (که بدون شک در پوست به آندروژن ها تبدیل می شود)به هیرسوتیسم مبتلا می شوند.
هیپرپلازی فوق کلیوی اکتسابی
CAH غیر کلاسیک (NC-CAH) که CAH دیررس،خفیف یا اکتسابی نیز نامیده می شود،به اختلال عملکرد غده آدرنال با تولید بالای آندروژن اطلاق می گردد.این حالت بیشترقبل یا بعد از سن بلوغ ظاهر می شود.تا زمان تولد یا اوایل کودکی،این اختلالات به دلیل نقص جزئی (OH-21(NC-CAH-21 ، سه بتا هیدروکسی استروئید دهیدروژناز (B-OH(NC-CAH-11)(NC-CAH-3hsd - نیز بروز می کنند.NC-CAH-21 مسئول بسیاری ازعوارض ازدیاد آندروژنهای قبل از بلوغ است.ژن فعال کد کننده آنزیم سیتوکروم P-450C21-OH در نزدیکی محل HLA-B و DR برروی بازوی کوتاه کروموزوم 6 قرار دارد (شکل 8).
درعارضه اختلال کلاسیک ارتباط مشخصی بین HLA-BW47 و DR7 دیده شده است.همچنین در مطالعات پیوستگی DNA و الل HLA-B14-DRI در حالات زیادی همراه با NC-CAH-21 بوده است. CAH-21 در فرم کلاسیک یا غیر کلاسیک یک بیماری اتوزومی مغلوب است. هتروزیگوت های CAH21 (کمبود شدید 21-OH/21-OH طبیعی) یا NC-CAH-21 (کمبود خفیف 21OH/21-OH طبیعی) علائم مردانگی را ظاهر نمی سازد.اما ازنظر شیمیایی با افراد هموزیگوت سالم تفاوت دارند،چرا که در پاسخ به تحریک مصنوعی ACTH مقدار کمی OHP-17 می سازند.
تغییرات فتوتیپی زیادی در NC-CAH روی می دهد. پیش بینی می شود ناهمگونی ژنتیکی فراوانی دراین مورد یافت شود. احتمالاً 3 نوع الل برای کمبود OH-21 طبیعی،OH-21 خفیف و 21-OH شدید وجود دارد.Speiser و New تقسیم بندی بیوشیمایی براساس پیوستگی HLA و مطالعات شجره شناسی انجام داده اند. پاسخ 17-OHP به ACTH در هموزیگوتهای خفیف (کمبود خفیف /21-OHکمبود خفیف 21-OH) درمقایسه با هتروزیگوت های مرکب (کمبود شدید 21OH/ کمبود خفیف 21-OH) بطور مشخصی کمتر می باشد.
تست های تشخیصی متعددی جهت تعریف NC-CAH از نظربیوشیمیایی مورد استفاده قرارگرفته اند.اغلب اما نه همیشه مقادیر پایه T,A;D و DHEA یا DHEAS افزایش دارد. زنان مبتلا به NC-CAH-21 از نظر تظاهرات بالینی و یا مقدار پایه اندروژن ها به راحتی از مبتلایان به PCOS قابل تمایزنیستند.مقدارOHP-17 پایه تحریک شده توسط ACTH که اول صبح اندازه گیری می شود،دراکثر بیماران مبتلا افزایش نشان می دهد.چنانچه مقدار 17-OHP بیش از300ng/dl بوده و با تحریک توسط ACTH به بیش از 800ng/dl برسد می توان به تشخیص قطعی NC-CAH رسید.درصورت عدم افزایش آندروژن های سرم (بخصوص اندروژن های 4دلتا قوی) بنظر می رسد آندروژن های دلتا5 و 17-OHP در بافتهای محیطی به آندروژن های قویتری تبدیل شوند.
NC-CAH-3hsdوNC-CAH-11
NC-CAH-3hsd قبل از بلوغ با افزایش فزاینده آندروژن ها تشخیص داده می شود. مانند NC-CAH-21 علائم بالینی NC-CAH-3hsd تفاوت بارزی با علائم PCOS ندارد،بجزاینکه قاعدگی نامنظم را در تمامی این بیماران نمی توان دید.یک نقص جزئی در سیستم آنزیم میکروزومی 3 بتا هیدروکسی استروئید دهیدروژناز تخمدان و فوق کلیه باعث تولید و ترشح بیش از حد 5 بتا استروئیدها می شود.
تشخیص از طریق اندازه گیری 17 هیدروکسی پرگننولون، DHEA و DHEAS پایه و پس از تحریک با ACTH، در مقایسه با دلتا4 اندروژن ها A D,17-OHP و T صورت می گیرد.
NC-CAH-3hsd پیوستگی به HLA ندارد و تاکنون وضعیت ناقل آنها شناخته نشده است.کمبود NC-CAH-11 یک علت غیر شایع برای علائم آندروژن اضافی است؛هرچند که گزارش قابل اعتماد از میزان شیوع آن در دسترس نیست. بهرحال تشخیص این حالت باید در زنان جوان پرمو با فشارخون بالا بخصوص آنهایی که دارای تاریخچه خانوادگی مثبت هستند مورد توجه قرار گیرد. تغییرات بیوشیمایی مشابه NC-CAH-21 است، اما میزان 11- دزوکسی کورتیزول نیز افزایش نشان می دهد.هیچگونه ارتباط پیوستگی بین ژنهای NC-CAH-11 و HLA شناخته نشده است.
اختلالات نئوپلاستیک فوق کلیوی
بیماری کوشینگ (عامل 70% از موارد افزایش کورتیزول) اغلب مواقع بدلیل وجود تومور ترشح کننده ACTH است.
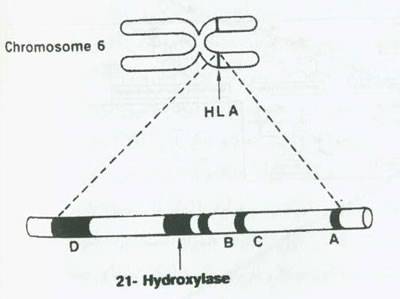
شکل 8: هیپرپلازی فوق کلیوی ارثی غیر کلاسیک 21-جایگاه ژنی 21 هیدروکسیلاز (سیتوکرم P-450C21) در کمپلکس HLA و برروی کروموزوم 6 انسان.
این توموربا هیپرپلازی دو طرفه آدرنال و افزایش کورتیزول و احتمالاً پرمویی و بندرت مردنمایی همراه است. درمواردی با شیوع کمتر(20%)،سندرم کوشینگ در اثر یک آدنوم یا کارسینوم ترشح کننده کورتیزول ایجاد می شود که با شیوع 20% مردنمایی همراه هست.سایرعلل افزایش کورتیزول، بدنبال ترشح نابجایی ACTH می باشد. علائم بالینی سندرم کوشینگ شامل ضعف عضلانی،اکیموز،افزایش فشارخون، استریاهای شکمی،چاقی مرکزی با استئوپورز و آلکالوز هیپوکالمیک است.
گاهی هیرسوتیسم و مردنمایی شدید با منشاء فوق کلیوی در مبتلایان به آدنوم یا کارسینوم فوق کلیه با ترشح آندروژن ها دیده می شود.کارسنیوم و (بندرت) آدنوم براساس درجه تمایز تومور ترکیبی از دلتا4 و دلتا5 آندروژنها را می سازند. ممکن است مقادیرA D و T بدون تغییر بارز در میزان DHEAS افزایش یابد اما عموماً مقداری DHEAS درمبتلایان به نئوپلاسم آدرنال به 800mg/dl می رسد. درمان سرکوب کننده با دگزامتازون معمولاً در این بیماران موثرنیست.بندرت یک تومور تولید کننده T (با ویژگی یک تخمدان در حال استراحت،شامل پاسخ دهی به هورمون جفتی انسان hCG) با بروز سریع علائم مردنمایی در فوق کلیه یافت می شود.
افزایش آندروژن مختلط تخمدانی -فوق کلیوی
افزایش تولید آندروژن توسط غده فوق کلیه و تخمدان دربسیاری از مطالعات و براساس کاتتریزاسیون فوق کلیه و تخمدان و سرکوب با دگزامتازون یا تحریک hCG دیده شده است.Kirschner و همکاران دریافتند که 30% بیماران پرمو دارای هر دو منبع فوق کلیوی و تخمدانی برای آندروژن های اضافی هستند. Abraham و همکاران نیز یک شیوع 29 درصدی را گزارش کرده اند.همانطور که مشخص است آندروژن های فوق کلیوی،تخمدآنها را یا بطور غیرمستقیم از طریق تبدیل استروژن (یعنی افزایش ترشح LH و تحریک آندروژن های تخمدان) یا مستقیماً با مهار آنزیم های 3 بتا هیدروکسی استروئید و هیدروژناز و آروماتازموجب بلوغ ناکافی فولیکولها و افزایش نسبت ترشح آندروژن به E2 توسط تخمدانها می شوند.تفسیر اطلاعات حاصل ازتحریک با دگزامتازون و hCG بعلت اثرات آنها برغدد مختلف (مثلاً هیپوفیز،آدرنال،تخمدان،باید با احتیاط صورت گیرد.آگونیست های GnRH با سرکوب ترشح تخمدانی و بدون اثر مشخصی برغدد فوق کلیه مورد استفاده قرار گرفته اند.
ارزیابی بالینی
ارزیابی وضعیت غدد در دختران مبتلا به پرمویی باید پیش از بلوغ انجام گیرد. همچنان در هر بیمار پرمو با شروع سریع یا شروع مردنمایی تظاهر یا پیشرفت پرمویی همراه با اختلالات قاعدگی (مثل PCOS) ممکن است جهت جلوگیری از یک فرایند جدی تر در هر سنی مورد ارزیابی قرار گیرد.
باید از متبلایان به پرمویی تاریخچه کاملی بخصوص زمان شروع و افزایش سرعت رشد مو را بدست آورد.یک تاریخچه از رشد سریع مو(اغلب با بروز مردنمایی)، نشانگر یک نئوپلاسم فوق کلیوی یا تخمدانی است.بیماران دارای علایم PCOS (شامل عدم تخمک گذاری مزمن و پرمویی)معمولاً افزایش تدریجی رشد مو را 3-2 سال بعد از شروع قاعدگی ذکر می کنند.
زنانی که قاعدگی منظم اما افزایش آندروژن دارند،ممکن است منبعی فوق کلیوی برای افزایش اندروژن خون داشته باشند. بیماران فاقد قاعدگی و دارای علائم پرمویی به منظورجداسازی و مستثنی نمودن اختلالات ژنتیکی وابسته به کروموزوم 6 درگنادها،باید از نظرکاریوتایپ لوکوسیتی مورد آزمایش قرار گیرند.
دختران نابالغ مبتلا به پرمویی باید برای تشخیص CAH و نئوپلاسم تخمدان یا آدرنال مورد بررسی قرار گیرند.درنهایت، باید عللی را که ناشی ازعوارض جانبی درمانهای پزشکی می باشند در نظر گرفت. دانازول (دانوکرین)،که در درمان آندومتریوز و بیماری کیست خوش خیم پستان به فراوانی مورد استفاده قرار می گیرند ممکن است موجب پرمویی و آکنه گردد وهمینطور برخی از پروژستوژنهای 19 نورتستوسترونی مورد استفاده درقرصهای خوراکی ضد بارداری نیز بعنوان عامل پرمویی و آکنه گزارش شده اند.فنی توئین سدیم،پنی سیلین،مینوکسیدیل و دیازوکسید ممکن است موجب پرمویی شوند(که بصورت افزایش رشد موی غیرجنسی (Vellus) تعریف شده است). همچنین این حالت در بیماران مبتلا به بی اشتهایی عصبی،درماتومیوزیت و کم کاری تیروئید دیده می شود.معاینه فیزیکی جهت بررسی علائم آندروژن اضافی مورد نیاز است.
شکل و انتشار مو باید درجه بندی شده و در صورت امکان تصویربرداری شود. در بررسی پرمویی روشهای درجه بندی مختلفی پیشنهاد شده است. شاید عملی ترین و مورد استفاده ترین آنها مقیاس (F-G(Fariman-Galloway است که بصورت نیمه کمی رشد مورا در 12 ناحیه بدن درجه بندی می کند.(شکل 10). میانگین نمره F-G در زنانی طبیعی بین 7-4 است.نمره تک ناحیه ای بین صفر و 2 و نمره FG معادل 8 در پرمویی خفیف یافت می شود.زنان مبتلا به پرمویی خفیف بطور مشخص موهای نرم و رنگدانه ای برروی صورت (یعنی طرفین لبها و چانه اما نه به صورت ریش کامل)،قفسه سینه و زیر شکم دارند.درپرمویی متوسط،نمره نواحی مقعر و بین 3-1 می باشد. دراین زنان موهای زبر که انتهای آنها پیگمانته است بر روی اندامها،صورت (اما نه ریش کامل)،قفسه سینه،شکم و ناحیه پرینه وجود دارد. پرمویی شدید (یعنی نمره 4-3 و نمره کلی 16F-G یا بیشتر) بصورت موهای زبر پیگمانته برروی ناحیه بالای لب و انتشار وسیعتر برروی سایر نواحی حساس به آندروژن ها تعریف می شود.میزان تأثیر درمان درکار آزمایی های بالینی داروها با کاهش قطر موها قابل اندازه گیری است. دیگرعلائم آندروژن اضافی قطر موها قابل اندازه گیری است.دیگر علایم آندروژن اضافی مانند آکنه و علائم افزایش کورتیزول (یعنی سندرم کوشینگ) باید به دقت بررسی شود.بزرگی کلیتوریس معمولاً در مقادیر توموری T دیده می شود.
جهت تعریف بزرگی کلیتوریس باید سطح کلیتوریس اندازه گیری شود(با ضرب نمودن طول در پهنای کلیتوریس) مقادیر بیش از 35 میلیمتر مربع نشان دهنده اختلال است.روش دیگر پیشنهاد شده اندازه گیری پهنای کلیتوریس است که نباید بیش از 1 سانتی مترباشد.تصویر برداری کامپیوتری (CT) از شکم و لگن یا تصویر برداری رزونانس مغناطیسی (MRI) و مطالعات سونوگرافی لگن نیز برای تشخیص نئوپلاسمهای تخمدانی و یکطرفه تولید کننده آندروژن در 80-60 درصد موارد قابل لمس است.
بررسی های آزمایشگاهی
در غربالگری به منظور کنارگذاشتن نئوپلاسم های مترشحه آندروژن از تخمدان یا فوق کلیه و یا نئوپلاسم های هیپوفیزی ترشح کننده پرولاکتین،میزان تستوسترون، دهیدرواپی اندروسترون سولفات و پرولاکتین را در سرم اندازه گیری می کنند. سپس میزان تستوسترون و DHEAS به تعیین منبع ترشح آندروژن کمک می کند. زنان مبتلا به PCOS مقادیرطبیعی و یا افزایش یافته تستوسترون (-60-150ng/dl) از خود نشان می دهند. میزان DHEAS طبیعی و یا اندکی افزایش یافته است (450mg/dl>). چنانچه میزان تستوسترون (T) از 150ng/dl بیشتر گزارش شده باشد،نمونه گیری مجدد و ارجاع به آزمایشگاه معتبر توصیه می گردد.دربیماران با تومور تخمدانی عموماً میزان تستوسترون بیشتر از 200ng/dl می باشد.مقادیرتستوسترون بیشتر از این الزاماً نشانه نئوپلاسم نیست.
فریدمن و همکارانش فقط در 2 نفر از 11 نفر با تستوسترون بالاتر از 200ng/dl در لاپاروسکوپی،نئوپلاسم تخمدان را مشاهده کردند(بدون توده قابل لمس) چنانچه افزایش تستوسترون و نیز بزرگی دو طرفه و کیست های تخمدانی در سونوگرافی تخمدان مشاهده شد،احتمال PCOS وجود دارد وشروع درمان با ادامه روش های تخشیصی (تشخیص جراحی یا کاتتریزاسیون وریدی)،ترجیح داده می شود. تستوسترون افزایش یافته،توده یک طرفه تخمدانی و تشدید علایم ازدیاد آندروژنی، تشخیص های جراحی را توصیه می کند.
چنانچه دریک پرمویی یا مردنمایی شدید، وجود نئوپلاسم تخمدانی مورد تردید باشد، کاتتریزاسیون رتروگراد وریدی جهت تمایز منبع تخمدانی از فوق کلیوی استفاده می شود.این عمل همچنین برای تشخیص سمت مبتلا مفید است.کاتتریزاسیون وریدی یا شریانی هم از لحاظ تکنیک مشکل و هم درصد کمی مرگ و میر بدنبال دارد. لذا برای اندیکاسیون های خاصی از آن استفاده می شود.تصویربرداری رزونانس مغناطیسی دقیق ترین ابزار تشخیصی برای تومور محسوب می شود.
مقدار DHEAS بیش از 800mg/dl نشانگر عارضه فوق کلیوی است.همراه با افزایش DHEAS باید یک تاریخچه خانوادگی از CAH،بروز پرمویی شدید نزدیک به قاعدگی،میزان 17-OHP پایه و تحریک شده توسط ACTH را بدست آورد. درصورت مشکوک بودن به موارد کمیاب NC-CAH-3hsd یا NC-CAH-11 لازم است A D و Aدلتا آندروستندیول برای نسبت های دلتا5:دلتا4 درموارد کمبود 3 بتا هیدروکسی استروئید دهیدروژناز و نیز11 دزوکسی کورتیزول در کمبود 11B-OH اندازه گیری شود.
درصورت مشکوک بودن به تومورفوق کلیوی مطالعات تصویربرداری (MR یا CT) دقیقترین روش تشخیص تومورهای مذکوراست.مقادیرافزایش یافته DHEAS و T در مبتلایان به بیماری یا سندرم کوشینگ نیز ممکن است دیده شود.پس از معاینه و گرفتن شرح حال درصورت شک به هیپرکورتیزولیسم یک تست غربالگری سرکوب دگزامتازون انجام می شود. دگزامتازون 1mg خوراکی ساعت 11 شب خورده شده و میزان کورتیزول پلاسما درساعت 8 صبح اندازه گیری می شود، چنانچه میزان کورتیزول بیش از 1mg/dl باشد،احتمال بیماری یا سندرم کوشینگ وجود دارد و مقادیرکمتراز 6mg/dl طبیعی است. مقادیر افزایش یافته و نامشخص می تواند با اندازه گیری مقادیر کورتیزول ادراری (بالاتر از حد نرمال 74mg/24h) و 17 - هیدروکسی کورتیکواستروئیدها (بالاتر از حد نرمال 8mg/24h) در ادرار 24 ساعته مورد ارزیابی قرار گیرد.
این مقادیر ادراری همچنین با سرکوب دگزامتازون با دوزکم (0/5mg خوراکی هر 6 ساعت به مدت 2 روز)اندازه گیری می شوند.سرکوب کورتیزول آزاد ادراربا دوز کم تا حد کمتر از 25mg در 24 ساعت یا 17 هیدروکسی کورتیکواستروئیدها تا کمتراز3mg در 24 ساعت موجب تمایزسندرم کوشینگ می شود کورتیزول در بیماری کوشینگ با دوز بالای دگزامتازون ممکن است سرکوب شود،در حالیکه در مبتلایان به نئوپلاسم فوق کلیوی و یا تومورهای نابجای ترشح کننده ACTH (یعنی سندرم کوشینگ) معمولاً سرکوب انجام نمی گیرد.اخیراً روشهای اندازه گیری دقیق تر ACTH، مطالعات کاتتریزاسیون فاکتور آزاد کننده کورتیکوتروپین (CRF) و استفاده بیشترازتصویربرداری CT و MR فوق کلیوی موجب دستیابی به تشخیصهای حساس ترو قابل اعتمادتری دراختلالات ترشح کورتیزول اضافی می شود.
مقادیرطبیعی تاکمی افزایش یافته T و DHEAS معمولاً در زنان دارای پرمویی خفیف یا پیشرفته کند و یا متوسط دیده می شود.هنوزمشخص نیست که آیا اندازه گیری استروئیدها ضروری است یا خیر، معمولاً دروضعیتهای غیرتوموری( همانطور که درزیر شرح داده شده است) درمان ربطی به مقداری T و DHEAS یا نسبت ها ندارد.دراین موارد پرمویی با منشا نامشخص (ایدیوپاتیک)،میزان تبدیل آندروژن های خون به DHT افزایش دارد.ممکن است فردی
افزایش کمی در A D گردشی یا آزاد (غیر متصل به SHBG) داشته باشد.بطور ویژه تر، a-diol G-3 که یکی از متابولیت های عمده DHT است بالاست.کاربرد 3 آلفا دیول G بدلیل اندازه گیری مشکل آن و نیز کوچک بودن طیف اندیکاسیون های آن به استفاده در روشهای تحقیقاتی محدود شده است.
بعلت افزایش موارد هیپرپرولاکتینمی، چنانچه هیرسوتیسم با بی نظمی درقاعدگی همراه باشد،باید سطح پرولاکتین هم اندازه گیری شود.دربین زنان مبتلا به افزایش پرولاکتین خون در30-20% آنها DHEAS افزایش یافته اما T یا Aَ D ثابت است. بنظرمی رسد پرولاکتین مثلاً با ممانعت در افزایش SHBG و کاهش فعالیت 5- الفاردوکتاز،اثرات آندروژنی متعددی از خود بروز دهد.
درمان
درمان پرمویی زنان براساس علت و محل تولید آندروژن صورت می گیرد. درصورت تشخیص نئوپلاسم برداشتن یک تخمدان،یا تومورفوق کلیه یا هیپوفیز با جراحی انجام می شود.بمنظورکاهش ACTH در CAH-21 ترکیبی از گلوکوکورتیکوئیدها و مینرالوکورتیکوئیدها مورد استفاده قرار می گیرند،که موجب کاهش آندروژنهای (DHEA(دلتا5 و DHEAS در دسترس شده و مانع تبدیل آنها دربافتهای محیطی می گردند.
بهترین درمان جهت منابع فوق کلیه و در تولید اضافی آندروژنها یک گلوکوکورتیکوئید مصنوعی مانند دگزامتازون باید احتیاط لازم را بعمل آورد،زیرا دوزهای تجویز شده بصورت طولانی مدت بخصوص مقادیر بیش از 0/5mg درروز ممکن است منجر به اثرات شبه کوشینگ شود.ازسوی دیگر، باید برای جلوگیری ازآسیب به محور هیپوفیز فوق کلیه،کورتیزول صبحگاهی کنترل شده و در سطح 3mg/dl یا بیشتر حفظ شود.داروهای ضد بارداری خوراکی و دگزامتازون ممکن است در صورت استفاده توام موثرباشند.
داروهای ضدبارداری خوراکی
داروهای ضدبارداری خوراکی بعنوان اولین رده دارویی در درمان اشکال خفیف پرمویی مورد استفاده قرار می گیرند.داروهای ضدبارداری خوراکی ترشح هیپوفیز را سرکوب کرده و تولید A َD و T تخمدانی را کاهش می دهند.جزء پروژسترونی ممکن است به گیرنده های گلوکوکورتیکوئید اتصال یافته،موجب کاهش ترشح آندروژنهای فوق کلیه شود.جزء استروژنی، از طریق اثرمستقیم برکبد،باعث تحریک تولید SHBG می شود طی سالهای گذشته مطالب کمی در مورد استفاده فراوان از داروهای ضدبارداری خوراکی در درمان پرمویی بخصوص اشکال شدید آن نوشته شده است.
این داروها بعنوان درمان فرعی بهمراه درمانهای تهاجمی تر،بخصوص هنگام استفاده ازآگونیست های GnRH و آنتی آندروژنها مورد استفاده قرار می گیرد.
داروهای ضدبارداری خوراکی بهمراه یک آگونیست GnRH ازعوارض جانبی مانند گرگرفتگی و خشکی واژن کاسته و ممکن است موجب کاهش سایر واکشنهای ناخواسته مانند تغییرات ناخواسته در کلسترول و کاهش تراکم استخوان شود. همچنین داروهای ضد بارداری خوراکی در کاهش بی نظمی قاعدگی مفید هستند که این حالت معمولاً در درمان با آنتی آندروژنها دیده می شود.داروهای ضد بارداری خوراکی برای جلوگیری ازالقای زنانگی در جنین مذکر مادری که در زمان بارداری از آنتی آندروژنها استفاده کرده موثراست. داروهای ضدبارداری خوراکی احتمالاً از طریق کاهش تحریک هیپوفیزی آدرنال، ترشح آندروژن هی آدرنال را کاهش می دهند.
کتوکونازول
ماده ضدقارچ کتوکونازول (نیزورال) بعنوان بازدارنده عمل استروئیدسازی فوق کلیه و گنادها شناخته شده است.این ترکیب عمل خود را ازطریق ممانعت درمسیرهای آنزیمی سیتوکروم از جمله ساخت آندروژنها انجام می دهد.این ماده همچنین در روشهای درمانی معین مانند کانسر پروستات،بیماری کوشینگ،بلوغ زودرس و آدنوم یا کارسینوم سلول فوق کلیوی مورد استفاده قرار می گیرد.آسیب کبدی بخصوص هنگام مصرف دوزهای بالای کتوکونازول گزارش شده است.دوزدارو بین 1200mg- 400 در روز است. معمولاً دوز کمتر طی یک دوره شش ماهه مورد استفاده قرار می گیرد. مهمترین عوارض جانبی آن عبارتند از :خشکی پوست، تهوع،خستگی و ریزش مو بعلت اثرات جانبی،این دارو به فراوانی دیگر داروها مورد استفاده قرار نمی گیرد.
آگونیست های GnRH
آگونیست های GnRH سرکوب کننده قوی ترشح آندروژن های تخمدانی می باشند که از طریق سرکوب هیپوفیزی ترشح گونادوتروپینها عمل می کنند.دارو به صور تزریق زیرجلدی،اسپری داخل بینی دو تا سه بار درروز،تجویز داخل عضلانی ماهیانه و یا سه بار در ماه و کپسول زیر جلدی در دسترس می باشد.
معمولاً یک تا دو ماه پس از درمان ترشح تخمدانی و T و A D کاهش می یابند. بیشترین اثرات جانبی آگونیست های GnRH ثانویه به کاهش استروژن های خون هستند.این اثرات جانبی شامل گرگرفتگی،سردرد،خشکی واژن و تغییر خلق و خوی است. درمانهای طولانی ممکن است موجب کاهش تراکم استخوان شود. ترکیب آگونیستهای GnRH با ضد بارداریهای خوراکی باعث کاهش در تأثیر آن نمی شود و در آزمون های کنترل شده دوسوکور پیشرفت اثر مهار رشد موها نشان داده شده است.
آنتی آندروژنها
در بسیاری از داروها یک اثرآنتی آندروژنی دیده شده که ازطریق رقابت با T و DHT برای اتصال به گیرنده های آنها اعمال اثر می کنند.
اسپیرونولاکتون
اسپیرونولاکتون یک داروی مدر با خاصیت احتباس پتاسیم می باشد که به نظر می رسد با ممانعت از فعالیت 5- آلفاردوکتاز و اتصال رقابتی به گیرنده های داخل سلولی DHT موجب جلوگیری از رشد مو می شود.مقادیربالاتراسپیرونولاکتون با فعالیت سیتوکروم و P450 تداخل دارد که احتمالاً موجب کاهش تولید و ترشح آندروژن می شود.عوارض جانبی اسپیرونولاکتون عبارتند از قاعدگی نامنظم و در دوزهای بالاتر تهوع و خستگی،بعلت اینکه اسپیرونولاکتول یک عامل احتباس پتاسیم است،زنانی که قبلاً دچار هیپرکالمی شده اند باید درصورت استفاده از این دارو،بدقت پیگیری شوند و یا از داروی جایگزین استفاده نمایند.
سیپروترون استات
سیپروترون استات یک پروژسترون قوی است که مانع
ترشح گنادوتروپین هیپوفیزی می شود.این دارو هنوزدرآمریکا در دسترس نیست. سیپروترون استات همچنین بصورت رقابتی مانع اتصال T و D َA به گیرنده های آندروژن می شود.سیپروترون استات در بافت چربی ذخیره شده و نسبتاً به کندی آزاد می گردد.بعلت اثر پروژسترونی قوی این دارو معمولاً در بخش اول دوره قاعدگی (وبه میزان 200 -50 میلی گرم در روز، طی روزهای اول تا دهم)تجویز می گردد که طی روزهای پنجم تا بیست و پنجم اتینیل استرادیول هم به آن اضافه می شود.در زنانی که از داروهای ضد بارداری خوراکی استفاده می کنند،سیپروترون به میزان 50mg برابر 10 روز به خوبی تحمل می شود.دارو به صورت یک قرص مخلوط حاوی 2mg سیپروترون و 50mg اتینیل استرادیول طی روزهای 15-5 دوره قاعدگی مصرف می شود.دوزهای بالاتر سیپروترون درکاهش پرمویی موثرتر است. از عوارض جانبی سیپروترون افزایش وزن و آدم می باشند.این عوارض معمولاً با دوزهای بالاترسیپروترون همراهند و احتمالاً به دلیل فعالیت گلوکوکورتیکوئیدی ضعیف آن ظاهر می شوند.همچنین گزارشهایی ازافزایش آنزیمهای کبدی و هپاتیت بصورت گذرا وجود دارد.همانند اسپیرونولاکتون پیشگیری از حاملگی مهم است چرا که احتمال القاء زنانگی در جنین مذکر وجود دارد.
فلوتامید
فلوتامید (یولکسین Eulexin) یک آنتی آندروژن غیراستروئیدی خالص است که هیچ گونه فعالیت پروژسترونی، استروژنی،کورتیکوئیدی یا ضد گنادوتروپینی برای آن گزارش نشده است. در بیشتر مطالعات،مقادیر T و T آزاد خون محیطی بدون تغییر می مانند،گرچه برخی احتمال کاهش تولید آندروژن را گزارش کرده اند.فلوتامید هم به اندازه اسپیرونولاکتون و سیپروترون موثراست. این دارو برای درمان کانسر پروستات در مردان مورد استفاه قرار می گیرد.این دارو معمولاً با دوز 150-125 میلی گرم دوبار در روز مصرف می شود.شایعترین عوارض جانبی خشکی پوست افزایش اشتهاست.مهمترین عامل نگرانی بروز یک هپاتیت بالقوه کشنده توسط دارو است که در 0/5% از بیماران مصرف کننده دارو ایجاد می شود.همچنین فلوتامید همراه با فمینیزاسیون.دردستگاه تناسلی فرزندان نر موش همراه است که باید امکان وجود اثرات مشابهی درانسان را در نظر گرفت.
فیناسترید
فیناسترید (پروسکار) در درمان هیپرتروفی خوش خیم پروستات مورد استفاده قرار گرفته است.این دارو عموماً فقط بعنوان یک ممانعت کننده 5- آلفا ردوکتاز بدون هیچگونه اثر هورمونی شناخته شده است. سه ماه پس از درمان با این دارو مقادیر سرمی DHT و 3 آلقفا دیول G کاهش می یابد.فیناسترید بصورت روزانه 7/5-5 میلی گرم تجویز می شود.گرچه دوزهای تا 100mg نیز بدون عوارض جانبی درمردان مصرف شده است،حتی دوزهای کمتر (در حد 1mg) نیز ممکن است در درمان پرمویی به اندزه 5mg موثر باشد. این فرضیه هم اکنون در حال بررسی است. بجز سردرد ملایم و افسردگی،هیچ گونه عوارض جانبی مهمی برای این دارو گزارش نشده است.تناسلی مردانه درداخل رحم مادرشود.این دارو را می توان برای زنان پرمو که از بارداری جلوگیری می کنند،زنان عقیم و نیز زنان یائسه تجویز نمود.
برداشت مکانیکی مو
برداشت مکانیکی مو شامل تراشیدن،کندن، کرمهای نظافت،الکترولیز و استفاده از موم می تواند از درمانهای فرعی مهم در کنار درمان های پزشکی باشد.معمولاً برای آغاز تأثیر درمانهای پزشکی حداقل 6-3 ماه زمان لازم است و گاهی این زمان به بیش از یک سال می انجامد.طی این زمان،باید برداشت مکانیکی مو انجام گیرد(معمولاً این کار توسط پزشک مورد تأکید قرار نمی گیرد).تقریباً همیشه بیماران تصور غلطی از این مسئله دارند که تراشیدن مو موجب افزایش میزان و تراکم رشد مو می شود. تا زمانیکه تحریک رشد مو کاهش یابد، برداشت مکانیکی مو همزمان با درمان پزشکی موجب افزایش
رضایت بیمار می شود.این کاررا می توان پس از دستیابی به حداکثراثردرمانهای پزشکی نیز انجام داد.موبرهای شیمیایی که با هیدرولیز پیوندهای دی سولفید موجب برداشت مو می شود.ممکن است موجب آسیب پوستی و گاهی درماتیت شوند.
درنواحی متمرکز پرمو،کندن مو یا ازمو مفید است.هردو روش ممکن است موجب فولیکولیت شوند.استفاده موم گران بوده و گاهی راحت نیست.
الکترولیزدرمان رایجی است که سعی در تخریب فولیکول مو ازطریق الکترولیز و ترمولیزدارد.رشد مجدد مو در نیمی از افراد رایج است.پس ازدرمانهای متوالی با الکترولیز برخی بیماران درد زیاد،حلقه اسکار و مشکلات پیگمانتاسیون دارند. اشکال جدیدی ازاپیلاسیون پدید آمده است؛ مانند درمان با لیزر و نوردرمانی (با استفاده ازطول موجهای انتخابی)که با حرارت،مو و فولیکول آن را تخریب می کنند.ممکن است این روشها مزایایی نسبت به الکترولیز داشته باشند اما تاکنون به اندازه کافی مورد مطالعه قرارنگرفته اند.
ارزیابی درمانهای پزشکی پرمویی
این قسمت درمانهای انجام شده در مورد پرمویی را از سال 1987 تا 1997 بررسی می کند.این کار بعلت طبیعت ویژه پرمویی،مستلزم یک مقدمه طولانی در این مورد است.پرمویی بجز موارد نادر ارثی و حالتهای نئوپلاستیک که بیشتردرهمین فصل شرح داده شد،اغلب بعنوان یک مسئله آرایشی توسط پزشکان درمان می شود.بنا به دلایلی ارزیابی مطالب در درمان این اختلال مشکل است.روشی به عنوان درمان استاندارد شناخته نشده است تا براین اساس مورد ارزیابی قرار گیرد.
توضیحات Farriman و Galloway در سال 1961 اساساً بعنوان یک ابزار اپیدمیولوژیک مورد استفاده قرارگرفت. اندازه گیریهای کمی،دقیقتر بوده و تکرار پذیرند.این اندازه گیری ها عبارتنداز : قطرساقه مو و میزان رشد مو،که این کار با اندازه گیری وزن موی کنده شده یا تراشیده شده انجام پذیراست.تنها در 25% مطالعات حاضر این اندازه گیری های کمی گزارش شده است.تعداد موارد بیشتری ازاین متدهای کمی فاقد هرگونه استانداردی در اندازه گیری تأثیر فارماکولوژیک درمانهای پرمویی بوده اند.بخش دیگری از مشکل، بعلت تفاوت قابل توجه در میزان قطر ساقه و پراکندگی رشد موها درنواحی مختلف بدن می باشد.ساقه مو تخم مرغی شکل بوده و اندازه گیری آنها با یک روش مشکل است. تراشیدن یا کندن مو به منظور اندازه گیری وزن مو به طور مداوم درنواحی پرموی معینی ازبدن انجام می گیرد.این کار به اندازه گیری ها مشکل و پرزحمتی نیاز دارد.
مطالعات زیادی،تغییرمیزان پایه شاخص هایی مانند آندروژن ها،گنادوتروپین ها و SHBG را گزارش کرده اند.این شاخص ها که ازلحاظ آکادمیک مورد علاقه هستند نقطه پایانی درمان درکاهش تراکم موی انتهایی در نواحی حساس به آندروژن را مشخص نمی کنند.موارد بسیارکمی از مطالعات ارزیابی درمان توسط خود بیماران گزارش شده است.استاندارد نمودن میزان بهبود، کار مشکلی است،مثلاً عدم اطمینان از گزارش دفعات تراشیدن و یا کندن مو یا سایر درمانها را می توان ذکر کرد.
مطالعات هیرسوتیسم
سی و هفت مورد مطالعه در اینجا ارزیابی شده است.چهارمورد از روش دو سویه کور و به کمک پلاسبو انجام گرفته است. بقیه،کارآزماییهای بالینی هستند که از یک دارویا دو یا چند داروی تصادفی یا ترکیبی استفاده کرده اند.سنجش های نیمه کمی یا کیفی بعنوان یک اندازه گیری پایه پیش از درمان و نیز 6 ماه پس از آغاز درمان گزارش شده است.مطالعاتی که طی 6 ماه اندازه گیری های لازم را انجام نداده بودند بعلت غیرقابل مقایسه بودن از این مجموعه حذف گردیدند.بهرحال ممکن است جهت مشخص شدن مفیدترین اثردرمان دارویی به 6 ماه زمان (درمواردی یکسال یا بیشتر) نیاز باشد.دراین خلاصه چگونگی پاسخ زنان مبتلا به PCOS یا مبتلایان به پرمویی با منشا نامشخص مورد بررسی قرار نگرفته است.اختلاف ناچیزی
بین میزان موفقیت استفاده از داروهای مختلف در دو گروه وجود داشته است.
مطالعات دو سویه کوربا استفاده از پلاسبو
چهارمورد مطالعه دو سویه کوربا استفاده از پلاسبو انجام شده است.یکی با استفاده از آگونیست GnRH،یکی کتوکونازول و دو مورد با استفاده ازاسپیرونولاکتون، Heiner و همکاران،64 زن را بطور اتفاقی دریکی از 4 گروه زیر تقسیم کردند: 1) نافارلین استات(سینارل) که آگونیست GnRH است بعلاوه یک قرص ضد بارداری خوراکی(نوراتیندرون) و اتینیل استرادیول (نورینیل 1+35)، 2) اگونیست GnRH بعلاوه پلاسبو، 3) قرص ضد بارداری خوراکی بعلاوه پلاسبو. 4) پلاسبو دوبل.آنها با استفاده از اگونیست GnRH همرا ه با قرص ضد بارداری خوراکی کاهش بارزی در قطر ساقه مو تشخیص دادند،اما در سایر گروها هیچ کاهشی دیده نشد.همچنین تغییرمشخص در نمره F -G بین حالات قبل و بعد از درمان در هیچیک ازگروهها مشاهده نشد.
Akaline، کتوکونازول را همراه با پلاسبو در مورد 15 زن پرمو به روش دو سویه کور مورد استفاده قرارداد.به 9 نفر کتوکونازول به میزان روزانه 600mg و نیز به 6 نفر پلاسبو داده شد.پس از 6 ماه در 41% ازافراد گروه درمان شده و 2% از گروه پلاسبو نمره F-G کاهش یافت. اسپیرونولاکتون توسط Siegberg و همکارانش با استفاده از مخلوطی از دو گروه پرمو با منشاء نامعلوم و pcos مورد ارزیابی قرار گرفت،McClellan و همکارانش نیزازبیماران پر مو با منشاء نامعلوم در یک مطالعه دو سویه کور استفاده کردند.درمطالعه انجام شده توسط سیگبرگ و همکارانش تفاوت فاحشی درنمره F-G بین حالات قبل و بعد از درمان مشاهده شد و McClellan و همکارانش نیز در پایان تغییری در قطرساقه مو یا نمره F-G مشاهده نکردند.
کارآزمایی های بالینی
6 رده از داروها در 31 مورد مطالعه، ارزیابی شد.بسیاری ازاین روشها ترکیبی از روشهای کمی (قطر مو/ رشد مو)و نیمه کمی (نمره F-G) را مورد استفاده قرار دادند.نتایج از زمان پایه تا 6 ماه پس از درمان با اندازه گیری قطرساقه مو و یا رشد مو با نمره F-G بصورت تغییرات درصدی عرضه شد.شدت پرمویی بیمارانی که در این مطالعه مورد بررسی قرار گرفتند،تغییرات قابل ملاحظه ای داشت. همچنین ازآنجا که برخی محققین،نقاطی از بدن را که احتمالاً به آندروژن حساس نیستند درتعیین نمره F-G دخالت نمی دهند، تغییرات آشکاری در نمره F-G وجود داشت(مثلاً ساعد وساق پا و...) بطور خلاصه،تمام داروهای مورد بررسی دردرمان پرمویی متوسط تا شدید تأثیر نشان دادند.
درمطالعات مذکور هیچ یک از داروها بطور مشخص موثرتر از دیگری تشخیص داده نشده اند.بعلاوه درحالتهای اتفاقی متعدد، یک داروی بخصوص هیچ گونه مزیت درمانی آشکار نسبت به دیگری نداشته است.همانطورکه پیش بینی می شد در مطالعات کنترل شده دو سویه کور تصادفی نسبت به حالت غیر کنترلی و غیر کور تأثیر دارویی کمتری دیده شد.
نتیجه گیری
در حال حاضر هیچ داروی موثری توسط سازمان غذا و داروی ایالات متحده برای درمان پرمویی وجود ندارد.دراشکال خفیف تر پرمویی درزنانی که از روشهای آرایشی برداشت مکانیکی رضایت ندارند،بنظر می رسد بهترین داروی رده اول قرص ضد بارداری خوراکی است.هم چنین تأثیر دارویی اسپیرونولاکتون و سیپروترون برابر می باشد.احتمالاً عوارض جانبی اسپیرونولاکتون کمتربوده و سیپروترون درایالات متحده در دسترس نمی باشد.در اشکال شدیدتر پرمویی می توان بجای فلوتامید یا کتوکونازول از یک آگونیست GnRH همراه با یک داروی ضد بارداری خوراکی استفاده نمود،بخصوص هنگامیکه مشکلات کبدی وجود داشته باشد.بنظر می رسد که عوارض جانبی فیناسترید از همه کمتر بوده و درزنانی که احتمال بارداری آنها کم یا صفر است می تواند موثرباشد.
منبع:مامایی و بیماریهای زنان دنفورث(جلد دوم)
/ج